
甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
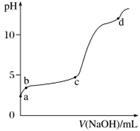
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-??Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.含极性键的分子一定是极性分子
C.判断A2B或AB2型分子为极性分子的依据:具有极性键且分子构型不对称、键角小于180°的非直线形结构
D.非极性分子中,各原子间不一定以非极性键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=___________________________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
肉桂醛是一种食用香精,广泛应用于牙膏、糖果及调味品中。工业中可以通过下列反应制得:
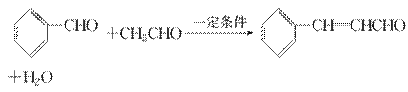
下列说法不正确的是 ( )。
A.肉桂醛的分子式为C9H8O
B.检验肉桂醛中是否残留有苯甲醛:加入酸性KMnO4溶液,看是否褪色
C.1 mol肉桂醛在一定条件下与H2加成,最多消耗5 mol H2
D.肉桂醛中所有原子可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com