
【题目】化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式__________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_____________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
【答案】Fe(OH)3 16.8L 1.5NA或9.03×1023 2Na2O2+2CO2=2Na2CO3+O2 NaHCO3=Na++HCO3- 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2HClO![]() 2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
【解析】
(1)还原剂是失去电子,化合价升高的微粒,根据反应方程式,Fe的化合价由+3价→+6价,化合价升高,即还原剂为Fe(OH)3,根据反应方程式,因此有![]() ,解得n(Cl2)=0.75mol,标准状况下,消耗氯气的体积为0.75mol×22.4L·mol-1=16.8L;转移电子物质的量为0.5mol×(6-3)=1.5mol,即转移电子数为1.5NA或9.03×1023;
,解得n(Cl2)=0.75mol,标准状况下,消耗氯气的体积为0.75mol×22.4L·mol-1=16.8L;转移电子物质的量为0.5mol×(6-3)=1.5mol,即转移电子数为1.5NA或9.03×1023;
(2)过氧化钠与CO2的反应:2Na2O2+2CO2=2Na2CO3+O2;
(3)小苏打是NaHCO3,在水中电离方程式为NaHCO3=Na++HCO3-;
(4)工业上制取漂白粉是将Cl2通入石灰乳中,即反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;新制氯水中有Cl2+H2O=HCl+HClO,HClO见光分解,2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(5)FeCl3与Cu的反应:2Fe3++Cu=Cu2++2Fe2+;铁比铜活泼,先发生Fe+2Fe3+=3Fe2+,如果FeCl3溶液过量,则Cu与FeCl3发生Cu+2Fe3+=2Fe2++Cu2+,
A、根据上述分析,如果Cu过量,则剩余固体中可能会有铜无铁,故A不符合题意;
B、根据上述分析,铁先参与反应,若FeCl3过量,Cu再参与反应,因此不可能出现有铁无铜的结果,故B符合题意;
C、根据上述分析,假如铁过量,则会出现,铁和铜同时存在的结果,故C不符合题意;
D、假如FeCl3溶液,将Fe和Cu全部消耗,即铜和铁均无剩余,故D不符合题意;
答案为B。


科目:高中化学 来源: 题型:
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
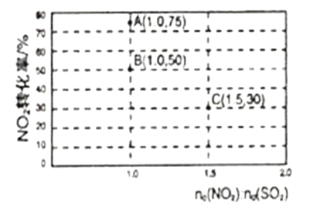
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
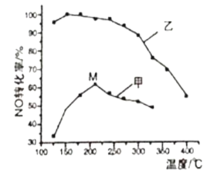
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
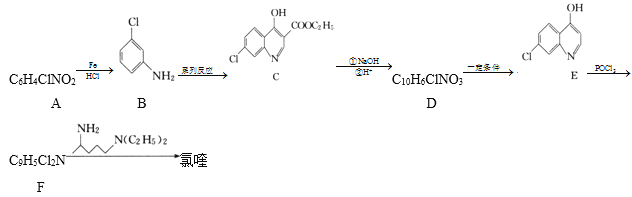
【题目】氯喹(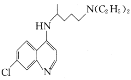 )可用于治疗新冠肺炎,氯喹的合成方法如图:
)可用于治疗新冠肺炎,氯喹的合成方法如图:
已知: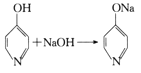 +H2O。
+H2O。
回答下列问题:
(1)A中所含官能团的名称是__,C的分子式为___。
(2)A生成B的反应类型为___,E生成F的反应类型为__。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。氯喹中的手性碳有__个。
(4)由C生成D的过程中,加入NaOH溶液时发生反应的化学方程式为___。
(5)X为E的同分异构体,写出一种满足如下条件的X的结构简式:___。
①遇FeCl3溶液发生显色反应
②除苯环外不含其他环,且苯环上只有2个取代基
③含有—CN
④核磁共振氢谱中只有4组峰,且峰面积之比为1:2:2:1
(6)设计以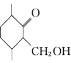 、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成
、CH3CH2CH2Br、CH3CH2ONa、CH3CH2OH为原料合成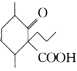 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
已知:R1CH2COOR2![]() R1CH(R3)COOR2
R1CH(R3)COOR2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4L SO3所含的氧原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的密闭容器中,不同温度下发生反应:2A(g)![]() 2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
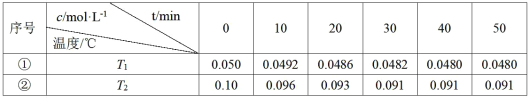
下列说法不正确的是( )
A.实验的温度:T2>T1
B.实验①前20min的平均反应速率v(C)=3.5×10-5molL-1min-1
C.实验②比实验①提前10min达到平衡
D.实验②中A的平衡转化率为9%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
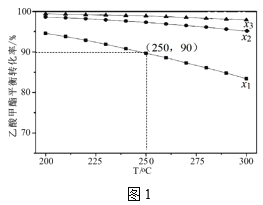
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
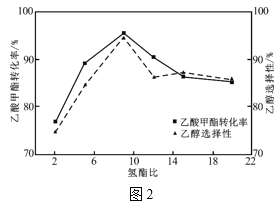
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
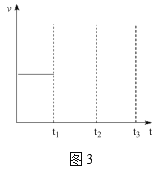
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,摩尔质量用M表示)样品的纯度,将mg样品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气,用V1mLc1molL1稀硫酸充分吸收,吸收后的溶液用c2molL1NaOH中和,平均消耗NaOH溶液的体积为V2mL。
(1)该样品中[Co(NH3)5Cl]Cl2的纯度为___;
(2)写出简要计算过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
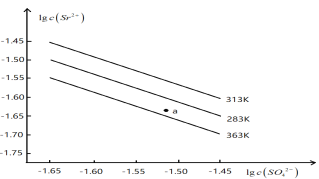
A. 温度一定时, Ksp(SrSO4)随c(SO42-)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 363 K时,图中a点对应的溶液是不饱和溶液
D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
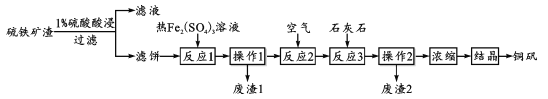
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com