
分析 加入少量铁粉,与氯化铁反应生成氯化亚铁,亚铁离子不能与KSCN溶液反应;上层清夜倒入另一试管,再加入几滴氯水,亚铁离子被氧化成铁离子,铁离子与KSCN溶液反应生成络离子,以此来解答.
解答 解:加入少量铁粉,与氯化铁反应生成氯化亚铁,离子反应为2Fe3++Fe=3Fe2+,溶液由黄色变为浅绿色,亚铁离子不能与KSCN溶液反应,则观察到溶液无明显现象;上层清夜倒入另一试管,再加入几滴氯水,亚铁离子被氧化成铁离子,离子反应为2Fe2++Cl2=2Fe3++2Cl-,铁离子与KSCN溶液反应生成络离子,观察到溶液变为血红色,
故答案为:浅绿;2Fe3++Fe=3Fe2+;溶液无明显现象;血红色;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查离子反应方程式的书写,为高频考点,侧重氧化还原反应的考查,注意发生的反应及现象的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
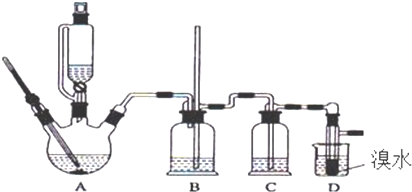
| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体的总质量不随时间而变化 | |
| B. | 单位时间内有nmolA2生成的同时就有nmolB2生成 | |
| C. | 2 v(A2)正=v(AB)逆 | |
| D. | A2、B2(g)、AB(g)的浓度之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将化学能转变为电能的装置叫做原电池 | |
| B. | 乙醇和沼气都是可再生能源 | |
| C. | CO2是造成酸雨的主要原因之一 | |
| D. | 质子数相同而中子数不同的同一元素的不同原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{A+16}$(A-n+8)mol | B. | $\frac{m}{A+16}$(A-n+10)mol | C. | (A-n+2)mol | D. | $\frac{m}{A}$(A-n+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
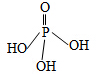 (1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为
(1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为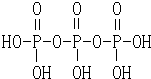 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
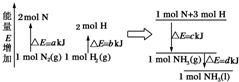 化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.
化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com