
| A. | 导电太阳能电池使用的高纯硅在工业生产过程中实现了零污染 | |
| B. | 生物质能来源于植物及其加工产品贮存的能量,姑动物粪便不属于生物质能 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 金刚石、C60、纳米碳管都是碳的同素异形体,都属于原子晶体,金刚石、石墨碳纳米管、C60均有很高的熔沸点. |
分析 A.高纯硅在工业生产中是利用碳还原二氧化硅生成硅和一氧化碳;
B.生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用,可转化为常规的固态、液态和气态燃料,取之不尽、用之不竭,是一种可再生能源;
C.酒精可以使蛋白质发生变性;
D.金刚石、纳米碳管都是碳的同素异形体,都属于原子晶体,C60为分子晶体.
解答 解:A.高纯硅在工业生产中是利用碳还原二氧化硅生成硅和一氧化碳,一氧化碳收有毒气体,粗硅和氯气反应生成四氯化硅,被氢气还原得到高纯硅和氯化氢,有污染,故A错误;
B.农业废弃物、动物粪便也是生物质能,故B错误;
C.酒精可以使蛋白质发生变性,因此可以用酒精消毒,故C正确;
D.C60为分子晶体,不是原子晶体,故D错误;
故选C.
点评 本题考查了硅及其化合物的性质应用、同素异形体和晶体结构的判断、能量变化的理解应用,注意知识的积累,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
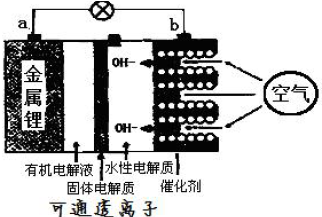
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①变轻,②变重,③不变 | B. | ①变轻,②不变,③变重 | ||
| C. | ①变轻,②不变,③不变 | D. | ①变重,②不变,③变轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
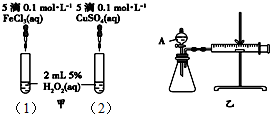 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
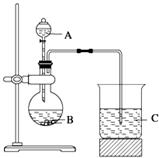
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com