
| A. | 0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 标准状况下,22.4LCHCl3含有的分子数为NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
分析 A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,1mol氯气参加反应转移1mol电子;
B.根据n=cV来计算;
C.标况下,CHCl3为液体;
D.硫离子为多元弱碱离子,水溶液中部分水解.
解答 解:A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,1mol氯气参加反应转移1mol电子,则0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA,故A正确;
B.pH=13,即C(H+)=10-13mol/L,C(OH-)=$\frac{10{\;}^{-14}}{10{\;}^{-13}}$mol/L=0.1mol/L,根据n=CV=0.1mol/L×1.0L=0.1mol,个数为NA个,故B错误;
C.标况下,CHCl3为液体,不能使用气体摩尔体积,故C错误;
D.硫离子为多元弱碱离子,水溶液中部分水解,所以1L 0.1mol•L-1的硫化钠溶液中硫离子数目小于0.1NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的计算,掌握公式的使用和物质的结构、状态是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | CO和HCl | B. | CH4和NH3 | C. | CH4和HCl | D. | H2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
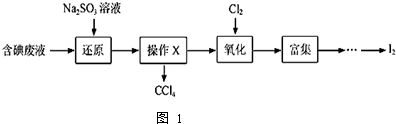
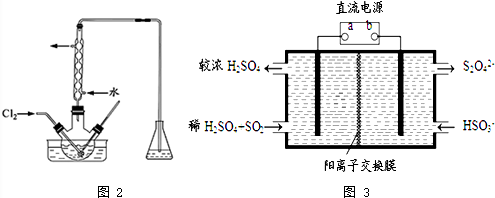
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
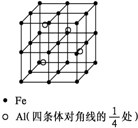 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3═K++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KClO3═K++ClO3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备催化剂的元素 | B. | 耐高温的合金元素 | ||
| C. | 用于半导体材料的元素 | D. | 制备农药的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3517Cl、3717Cl为不同核素,其化学性质不同 | |
| B. | 元素的相对原子质量,是按照该元素各种核素原子所占的一定百分比算出的平均值 | |
| C. | 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素发现 | |
| D. | 常温常压下,非金属元素的原子都能形成气态单质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 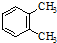 与 与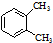 是同一物质 是同一物质 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟 | |
| C. | 煤先干馏得到的煤焦油再分馏分离出苯 | |
| D. | 向2mL苯中加入1mL溴水溶液,震荡后静置,可观察到液体分层,下层呈橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由氯乙烷制乙烯、由溴乙烷制乙醇 | |
| B. | 乙烯使溴的CCl4溶液褪色、甲苯使酸性高锰酸钾水溶液褪色 | |
| C. | 由HO-CH2-COOH制 、由氯乙烯制聚氯乙烯 、由氯乙烯制聚氯乙烯 | |
| D. | 由苯制硝基苯、由乙醇制取乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com