
| A. | 800mL0.5mol/L的NaCl溶液 | B. | 100mL0.3mol/L的AlCl3溶液 | ||
| C. | 500mL0.3mol/L的CaCl2溶液 | D. | 300mL0.3mol/L的MgCl2溶液 |
科目:高中化学 来源: 题型:选择题
| A. | 0.1 molCl2与足量Fe反应转移电子数为0.3NA | |
| B. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| C. | 常温常压下,4.2g环丙烷和聚乙烯的混合物中含有的碳原子数为0.3 NA | |
| D. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
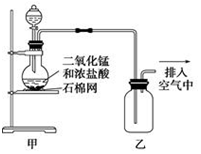
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA | |
| B. | 向足量水中通入1mol氯气,反应中转移的电子数为NA | |
| C. | 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA | |
| D. | 1L0.5mol•L-1Na2CO3溶液中阴离子的总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
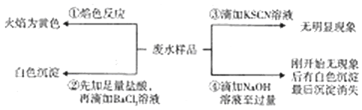
| A. | 废水含有Na+,不含K+ | B. | 废水含有SO42-和CO32- | ||
| C. | 废水不含Fe3+,可能含Fe2+ | D. | 废水一定含有Na+、Al3+、SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
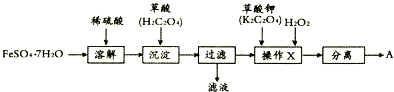
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com