
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。
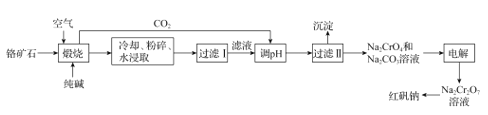
已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
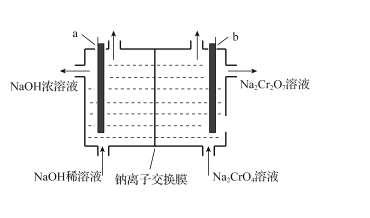
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。
【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 d Na2CO3 H2SiO3、AI(OH)3 加热浓缩、冷却结晶、过滤 2H2O+2e-=2OH-+H2(或2H++2e-=H2) 50%
4Na2CrO4+4CO2 d Na2CO3 H2SiO3、AI(OH)3 加热浓缩、冷却结晶、过滤 2H2O+2e-=2OH-+H2(或2H++2e-=H2) 50%
【解析】
将铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)和纯碱、空气煅烧,发生反应得到NaAlO2、Na2CrO4、Na2SiO3、Na2CO3,然后水浸、过滤得到浸出液,浸出液中溶质是NaAlO2、Na2CrO4、Na2SiO3、Na2CO3 ,在浸出液中利用焙烧产生的二氧化碳调整溶液pH ,依据流程可知,溶液中偏铝酸钠、Na2SiO3生成硅酸沉淀和氢氧化铝沉淀,然后过滤得到滤液和沉淀,沉淀是H2SiO3、AI(OH)3,滤液中含有Na2CrO4和Na2CO3 ,加入酸继续调节溶液的pH ,根据信息②知,溶质变为Na2Cr2O7,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体。
(1)根据流程和上述分析,“煅烧’’时,Cr2O3与加入的纯碱、空气高温下反应生成Na2CrO4和二氧化碳,化学反应方程式为:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2;陶瓷、玻璃、石英当中都含有二氧化硅,煅烧时加入的纯碱会与二氧化硅反应,损坏实验装置,因此因该在铁坩埚中进行煅烧操作。
4Na2CrO4+4CO2;陶瓷、玻璃、石英当中都含有二氧化硅,煅烧时加入的纯碱会与二氧化硅反应,损坏实验装置,因此因该在铁坩埚中进行煅烧操作。
答案为:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 ;d
4Na2CrO4+4CO2 ;d
(2)流程图中。“过滤II”后得到溶液中含有Na2CO3,将混合溶液蒸发浓缩、冷却结晶得到Na2Cr2O7晶体后得到的滤液中含有大量Na2CO3可用于煅烧操作。
答案为:Na2CO3;
(3)浸出液中利用焙烧产生的二氧化碳调整溶液pH ,二氧化碳溶于水溶液显酸性,滤液中的偏铝酸钠、Na2SiO3转化为硅酸沉淀和氢氧化铝沉淀。
答案为:H2SiO3、AI(OH)3;
(4)由Na2Cr2O7溶液制备红矾钠固体,操作为蒸发浓缩、冷却结晶、过滤洗涤。
答案为:蒸发浓缩、冷却结晶、过滤;
(5)根据电解池中a电极端,加入稀氢氧化钠,相当于电解水,流出浓氢氧化钠,说明a电极周围产生大量氢氧根离子,因此可得a电极上水中氢离子得到电子转变为氢气和氢氧根,因此电极a为阴极,电极式为2H2O+2e-=2OH-+H2(或2H++2e-=H2);b电极为阳极,溶液中阴离子放电,根据放电顺序氢氧根大于含氧酸根(CrO42-),因此b电极为水中的氢氧根离子失去电子转变为氧气和氢离子,在氢离子存在的情况下,根据已知信息2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012可得,
Cr2O72- +H2O K=1.0×1012可得,![]() ,溶液的pH=6,即
,溶液的pH=6,即![]() =1.0×10-6mol/L,K=
=1.0×10-6mol/L,K=![]() =
=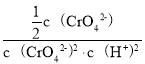 =
=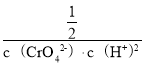 =1.0×1012,
=1.0×1012,![]() =0.5mol/L,因此当溶液pH=6时,溶液中剩余的CrO42-为0.5mol,消耗的CrO42-为0.5mol,Na2CrO4的转化率=
=0.5mol/L,因此当溶液pH=6时,溶液中剩余的CrO42-为0.5mol,消耗的CrO42-为0.5mol,Na2CrO4的转化率=![]() =50%;
=50%;
答案为:2H2O+2e-=2OH-+H2(或2H++2e-=H2);50%;


科目:高中化学 来源: 题型:
【题目】常温下,向![]() 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是
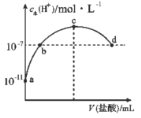
A.a点溶液中![]()
B.b、d两点溶液均呈中性
C.c点溶液中![]()
D.a、b之间的点可能满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如图。
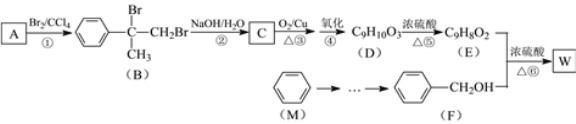
已知:![]() +CH3Cl
+CH3Cl![]()
![]() +HCl
+HCl
请回答下列问题:
(1)A的化学式是___,F的化学名称是___。
(2)②和⑤的反应类型分别____、____。
(3)E中含氧官能团是___(写名称),D聚合生成高分子化合物的结构简式为___。
(4)写出反应⑥的化学方程式:___。
(5)反应③的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为___________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃24mL,与过量氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度和压强,气体总体积缩小了54mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示![]() 或
或![]() ]与
]与![]() 的关系如图所示。已知碳酸
的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]() 。则下列说法正确的是
。则下列说法正确的是

A.曲线![]() 表示lg(
表示lg(![]() )与
)与![]() 的变化关系
的变化关系
B.![]() 的过程中,水的电离程度逐渐减小
的过程中,水的电离程度逐渐减小
C.当![]() 时
时![]()
D.当![]() 增大时,
增大时,![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷胺(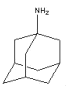 )是最早用于抑制流感病毒的抗病毒药,每片感康(复方氨酚烷胺片)含盐酸金刚烷胺100mg。金刚烷胺一般是由金刚烷合成的。金刚烷是一种重要的化工原料,由环戊二烯合成金刚烷的路线如下:
)是最早用于抑制流感病毒的抗病毒药,每片感康(复方氨酚烷胺片)含盐酸金刚烷胺100mg。金刚烷胺一般是由金刚烷合成的。金刚烷是一种重要的化工原料,由环戊二烯合成金刚烷的路线如下:
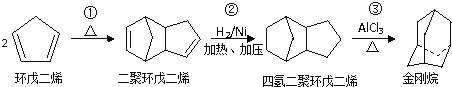
请回答下列问题:
(1)金刚烷的碳架结构相当于是金刚石晶格网络中的一个晶胞,故得金刚烷这个名字。它可看作是由四个等同的六元环组成的空间构型。金刚烷的二氯代物有___种。上述合成金刚烷的路线中,反应①的反应类型为___。
(2)金刚烷与四氢二聚环戊二烯的关系是___。(填字母)
a.均为环烃 b.均为烷烃 c.互为同系物 d.互为同分异构体
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
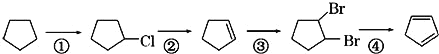
反应④的化学方程式为____。
(4)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目。
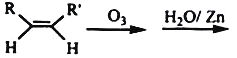 RCHO+R’CHO
RCHO+R’CHO
A是金刚烷的一种同分异构体,经臭氧氧化后的产物仅为一种,其结构为![]() ,试写出A可能的结构简式(任写一种)___。
,试写出A可能的结构简式(任写一种)___。
(5)B是二聚环戊二烯的同分异构体,B分子结构中有一个甲基,B能使溴的四氯化碳溶液褪色,B经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸(提示:苯环上的烷基(—CH3、—CH2R、—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基),B的结构有多种,其中核磁共振氢谱为6组峰,且面积比为3﹕2﹕2﹕2﹕1﹕2的结构简式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
A.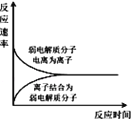 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.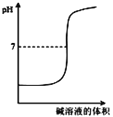 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.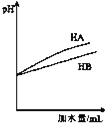 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.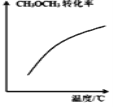 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)Fe位于元素周期表的_____区,Fe2+的价层电子排布图为_____。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显红色。含该离子的配合物的化学式是____。
②铁的另一种配合物铁氰化钾K3[Fe(CN)6]俗称赤血盐,可用于检验Fe2+,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理_____,该赤血盐其配体的电子式为:_____。
(3)Cu的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
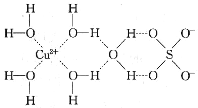
0.5mol该化合物中含有σ键的个数为_____。Cu2+与NH3还可形成[Cu(NH3)4]2+配离子,该配离子的立体构型为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com