
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
【答案】D
【解析】
根据图像,溶液中含有HA,说明HA为弱酸,即存在HA![]() H++A-,加入NaOH溶液,发生NaOH+HA=NaA+H2O,c(A-)/c(HA)比值增大,即
H++A-,加入NaOH溶液,发生NaOH+HA=NaA+H2O,c(A-)/c(HA)比值增大,即![]() ,
,![]() 减小,然后依据溶液中三个“守恒”进行分析;
减小,然后依据溶液中三个“守恒”进行分析;
A、HA为弱酸,即存在HA![]() H++A-,Ka=c(H+)×c(A-)/c(HA),
H++A-,Ka=c(H+)×c(A-)/c(HA),![]() ,时,Ka=c(H+)=10-4.76=10-5+0.24,即数量级为10-5,故A说法正确;
,时,Ka=c(H+)=10-4.76=10-5+0.24,即数量级为10-5,故A说法正确;
B、![]() ,Ka和Kw只受温度的影响,因此该比值保持不变,故B说法正确;
,Ka和Kw只受温度的影响,因此该比值保持不变,故B说法正确;
C、根据电荷守恒,m点所示溶液中:c(H+)+c(Na+)=c(OH-)+c(A-),由A选项分析,m点时,c(A-)=c(HA),因此有c(H+)=c(HA)+c(OH-)-c(Na+),故C说法正确;
D、n点时溶液pH=2,HA的物质的量大于NaOH的物质的量,则此时溶液中:c(Na+)<c(A-)+c(HA),故D说法错误。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】图为常温下![]() 溶液逐滴加入到
溶液逐滴加入到![]() 溶液中pH的变化曲线,下列说法 不正确的是
溶液中pH的变化曲线,下列说法 不正确的是

A.在![]() 区间内某点,两溶液恰好完全反应
区间内某点,两溶液恰好完全反应
B.反应过程中溶液中阴、阳离子总数:b点小于c点
C.![]() 区间内
区间内![]() 不包含a、c两点
不包含a、c两点![]() 可能存在:
可能存在:![]()
D.d点时溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
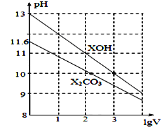
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 、体积均为
、体积均为![]() 的NaX、NaY溶液分别加水稀释至体积为
的NaX、NaY溶液分别加水稀释至体积为![]() 与
与![]() 的变化关系如图所示。已知
的变化关系如图所示。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )

A.水的电离程度a点大于b点
B.HX、HY都是弱酸,且![]()
C.![]() 时,NaX溶液所含离子总数大于NaY溶液
时,NaX溶液所含离子总数大于NaY溶液
D.分别向稀释前的两种溶液中加入盐酸至![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸、浓硫酸反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O;
下列有关叙述正确的是( )
A.氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6molI2,转移的电子数目为2.4NA
D.反应②③中等量的Se消耗浓硫酸和浓硝酸中溶质的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个![]() 键和1个大
键和1个大![]() 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
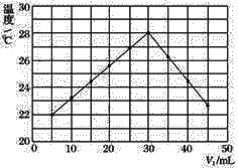
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L1二元弱酸H2A的溶液中逐滴加入NaOH溶液,H2A、HA-、A2的物质的量分数随pH的变化如图所示。下列叙述正确的是( )
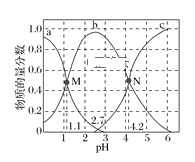
A.a曲线代表HA的物质的量分数随pH的变化
B.M点pH=1.1时,溶液中微粒浓度关系为c(H+)>c(HA)=c(H2A)
C.pH=2.7时,c(A2)+c(HA)+c(H2A)=0.1mol·L1
D.N点pH=4.2时,c(A2)=c(HA),溶液中不存在H2A分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
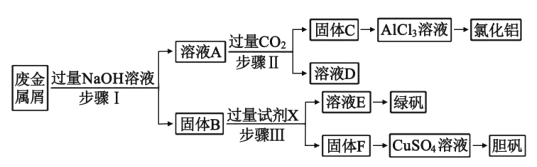
请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为___,涉及到的分离操作是___。
(2)试剂X是___;溶液D是___。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化___。
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是___。
(5)工业上常用溶液E制取净水剂Na2FeO4,流程如图:
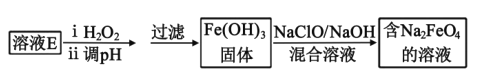
写出由Fe(OH)3制取Na2FeO4的离子方程式___。(已知NaClO还原为NaCl)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com