
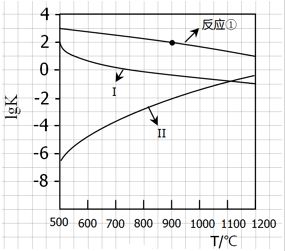
·ÖĪö £Ø1£©ČōA”¢B”¢C¶¼ŹĒĘųĢ壬¼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬ĖµĆ÷Õż·“Ó¦ŹĒĘųĢåĢå»żŌö“óµÄ·½Ļņ£»
£Ø2£©ČōA”¢B”¢C¶¼ŹĒĘųĢå£¬Ń¹Ēæøı䏱£¬Ę½ŗā²»·¢ÉśŅĘ¶Æ£¬ĖµĆ÷Į½±ßĘųĢå¼ĘĮæŹżĻąµČ£»
£Ø3£©ČōA”¢CŹĒĘųĢ壬Ōö¼ÓBµÄĮæ£¬Ę½ŗā²»ŅĘ¶Æ£¬ĖµĆ÷BµÄÅØ¶Č²»±ä£¬æÉŅŌŹĒŅŗĢåŅ²æÉŅŌŹĒ¹ĢĢ壻
£Ø4£©ČōA”¢CŹĒĘųĢ壬BŹĒ¹ĢĢ壬ĒŅ m£¾p£¬Ōö“óŃ¹ĒæŹ±Ę½ŗāĻņĘųĢåĢå»ż¼õÉŁµÄ·½ĻņŅĘ¶Æ£»
£Ø5£©ŅņĪĀ¶ČÉżøߣ¬Ę½ŗāĻņĪüČȵķ½ĻņŅĘ¶Æ£¬CµÄÖŹĮæŌö¼Ó£¬ĖµĆ÷Õż·“Ó¦ŹĒĪüČČ·“Ó¦£®
½ā“š ½ā£ŗ£Ø1£©Ņņ¼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņĘųĢåĢå»żŌö“óµÄ·½ĻņŅĘ¶Æ£¬ĖłŅŌm+n£¼p£¬¹Ź“š°øĪŖ£ŗ£¼£»
£Ø2£©ČōA”¢B”¢C¶¼ŹĒĘųĢå£¬Ń¹Ēæøı䏱£¬Ę½ŗā²»·¢ÉśŅĘ¶Æ£¬ĖµĆ÷Į½±ßĘųĢå¼ĘĮæŹżĻąµČ£¬Ōņm+n=p£¬¹Ź“š°øĪŖ£ŗ=£»
£Ø3£©Ōö¼ÓBµÄĮæ£¬Ę½ŗā²»ŅĘ¶Æ£¬ĖµĆ÷BµÄÅØ¶Č²»±ä£¬æÉŅŌŹĒŅŗĢåŅ²æÉŅŌŹĒ¹ĢĢ壬¹Ź“š°øĪŖ£ŗ¹Ģ»ņŅŗ£»
£Ø4£©ČōA”¢CŹĒĘųĢ壬BŹĒ¹ĢĢ壬ĒŅ m£¾p£¬Ōö“óŃ¹ĒæŹ±Ę½ŗāĻņĘųĢåĢå»ż¼õÉŁµÄ·½ĻņŅĘ¶Æ£¬ĖłŅŌĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬¹Ź“š°øĪŖ£ŗÕż£»
£Ø5£©ŅņĪĀ¶ČÉżøߣ¬Ę½ŗāĻņĪüČȵķ½ĻņŅĘ¶Æ£¬CµÄÖŹĮæŌö¼Ó£¬ĖµĆ÷Õż·“Ó¦ŹĒĪüČČ·“Ó¦£¬¹Ź“š°øĪŖ£ŗĪüČČ£®
µćĘĄ ½ā“š±¾ĢāµÄ¹Ų¼üŹĒĶā½ēĢõ¼ž£ØÅØ¶Č”¢ĪĀ¶Č”¢Ń¹Ē棩¶Ō»ÆŃ§Ę½ŗāµÄÓ°Ļģ£¬Č»ŗó¶ŌĪŹĢā×ö³öÕżČ·µÄÅŠ¶Ļ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al3+ | B£® | K+ | C£® | HS- | D£® | A1O2- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÓĆCaSO4“śĢęO2ÓėČ¼ĮĻCO·“Ó¦£¬¼ČæÉŅŌĢįøßČ¼ÉÕŠ§ĀŹ£¬ÓÖÄܵƵ½øß“æCO2£¬ŹĒŅ»ÖÖøߊ§”¢Ēå½ą”¢¾¼ĆµÄŠĀŠĶČ¼ÉÕ¼¼Źõ£¬·“Ó¦¢ŁĪŖÖ÷·“Ó¦£¬·“Ó¦¢ŚŗĶ¢ŪĪŖø±·“Ó¦£®
ÓĆCaSO4“śĢęO2ÓėČ¼ĮĻCO·“Ó¦£¬¼ČæÉŅŌĢįøßČ¼ÉÕŠ§ĀŹ£¬ÓÖÄܵƵ½øß“æCO2£¬ŹĒŅ»ÖÖøߊ§”¢Ēå½ą”¢¾¼ĆµÄŠĀŠĶČ¼ÉÕ¼¼Źõ£¬·“Ó¦¢ŁĪŖÖ÷·“Ó¦£¬·“Ó¦¢ŚŗĶ¢ŪĪŖø±·“Ó¦£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
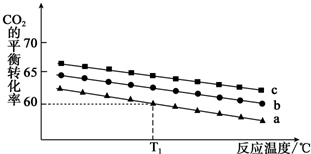
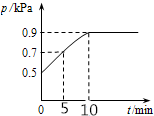 ŌŚ10LĆܱÕČŻĘ÷ÖŠ·ÅČė0.50 mol X£¬ŌŚŅ»¶ØĪĀ¶ČĻĀ·¢Éś·“Ó¦£ŗX£Øg£©?2Y£Øg£©+Z£Øs£©”÷H£¾0£¬ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ£Ø””””£©
ŌŚ10LĆܱÕČŻĘ÷ÖŠ·ÅČė0.50 mol X£¬ŌŚŅ»¶ØĪĀ¶ČĻĀ·¢Éś·“Ó¦£ŗX£Øg£©?2Y£Øg£©+Z£Øs£©”÷H£¾0£¬ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ£Ø””””£©| A£® | øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK=0.64mol/L | |
| B£® | “Ó·“Ó¦æŖŹ¼µ½t1Ź±µÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØX£©=0.008mol/£ØL•min£© | |
| C£® | ÓūĢįøßĘ½ŗāĢåĻµÖŠYµÄĢå»ż·ÖŹż£¬æÉÉżøßĢåĻµĪĀ¶Č»ņ¼õÉŁZµÄĮæ | |
| D£® | ĘäĖūĢõ¼ž²»±ä£¬ŌŁ³äČė0.1 mol ĘųĢåX£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬XµÄ×Ŗ»ÆĀŹŌö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ·ÓĄą-OH
·ÓĄą-OH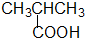 ōČĖįĄą-COOH
ōČĖįĄą-COOH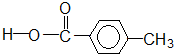 Č©Ąą
Č©Ąą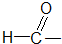
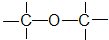
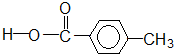 õ„Ąą
õ„Ąą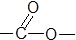
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż | B£® | ¢Ś¢Ü | C£® | ¢Ś¢Ū¢Ü | D£® | ¢Ś¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
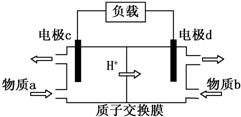
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 23 gÄĘŌŚŃõĘųÖŠĶźČ«Č¼ÉÕŹ§µē×ÓŹżĪŖ0.5NA | |
| B£® | ±ź×¼×“æöĻĀ£¬22.4 L±½Ėłŗ¬µÄ·Ö×ÓŹż | |
| C£® | ŹŅĪĀĻĀ£¬8 g¼×Ķéŗ¬ÓŠ¹²¼Ū¼üŹżĪŖ2NA | |
| D£® | 1 L 1 mol•L-1ĮņĖįČÜŅŗĖłŗ¬µÄH+Źż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
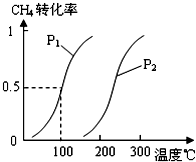 ¼×“¼±»³ĘĪŖ2lŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£¬¹¤ŅµÉĻĶعżĻĀĮŠ·“Ó¦¢Ł¢Ś£¬ÓĆCH4ŗĶH2OĪŖŌĮĻĄ“Öʱø¼×“¼£®
¼×“¼±»³ĘĪŖ2lŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£¬¹¤ŅµÉĻĶعżĻĀĮŠ·“Ó¦¢Ł¢Ś£¬ÓĆCH4ŗĶH2OĪŖŌĮĻĄ“Öʱø¼×“¼£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com