
【题目】下列说法正确的是
A. 碳酸钠是重要化工原料,可用于制玻璃、造纸等
B. SO2可用于漂白纸浆、草帽和酸性高锰酸钾溶液
C. 溴单质只存在于海洋中,因此溴被称为“海洋元素”
D. 常温下铁遇浓硫酸不反应,因此可用铁槽车储运浓硫酸
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:
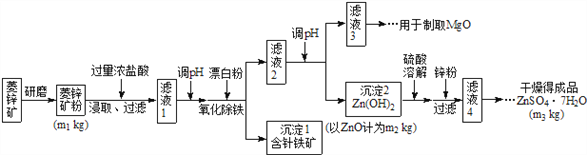
请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
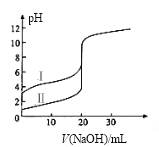
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH) =10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.V(NaOH) =20.00mL时,两溶液中 c(CH3COO-)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 1molL﹣1Al2(SO4)3溶液中,含Al3+离子的物质的量( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
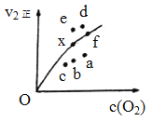
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
由实验数据得到v2正~[O2]的关系可用右图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为 (填字母)。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3·H2O=NH4NO3+NH4NO2+H2O。若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+) c(NO3-)+c(NO2-)(填“>”“<”或“=”)。工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。
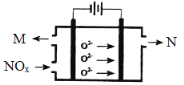
该电解池阴极的电极反应式是 。阳极产生的气体N的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl;
2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI;
3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O;
KCN+CO2+H2O=HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A.热稳定性:NaCl>NaClO4>NaClO
B.还原性(碱性溶液):Fe(OH)2>I2>KIO3
C.氧化性(酸性溶液):FeCl3>Co(OH)3>I2
D.酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物异搏定路线中某一步骤如下:

下列说法正确的是( )
A. 物质X在空气中不易被氧化
B. 物质Y中只含一个手性碳原子
C. 物质Z中所有碳原子不可能在同一平面内
D. 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com