
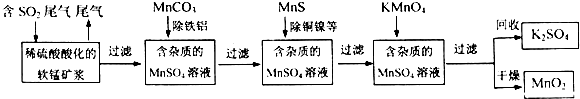
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,阴极上是水中的氢离子放电生成氢气,据此分析;
(5)用碘-淀粉溶液测定燃煤尾气中SO2的含量,根据电子得失守恒有关系式I2~SO2,根据消耗碘的物质的量可计算出二氧化硫的体积,进而确定尾气中SO2的体积百分含量;
(6)由MnSO4溶液得到MnSO4•H2O晶体,应蒸发浓缩、冷却结晶、过滤及干燥.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要用到的硅酸盐仪器有漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{8.4×1{0}^{\;}{\;}^{-45}}{1.4×10{\;}^{-19}}$=6.0×10-26mol/L,
故答案为:6.0×10-26;
(4)电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,电极反应式为MnO42--e-═MnO4-,阴极上是水中的氢离子放电生成氢气,所以阴极附近有氢氧根离子产生,溶液的pH将会增大,
故答案为:隋性电极;MnO42--e-═MnO4-;增大;
(5)用碘-淀粉溶液测定燃煤尾气中SO2的含量,根据电子得失守恒有关系式I2~SO2,反应中消耗碘的物质的量为VaL×10-3×cmo1•L-1×$\frac{1}{10}$=cVa×10-4mo1,所以二氧化硫的体积为cVa×10-4mo1×22.4L/mol=22.4cVa×10-4L=2.24cVamL,所以尾气中SO2的体积百分含量为$\frac{2.24cV{\;}_{a}mL}{V{\;}_{b}mL}$×100%=$\frac{2.24cV{\;}_{a}}{V{\;}_{b}}$×100%,
故答案为:$\frac{2.24cV{\;}_{a}}{V{\;}_{b}}$×100%;
(6)由MnSO4溶液得到MnSO4•H2O晶体,应蒸发浓缩、冷却结晶、过滤及干燥,
故答案为:蒸发浓缩、冷却结晶.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 乙烯的结构简式 CH2CH2 | |
| B. | 氯离子的结构示意图: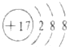 | |
| C. | H2O的电子式: | |
| D. | 碳酸钾的电离方程式 K2SO4=K2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LO2所含的原子数为1.5NA | |
| B. | 常温常压下,18gH2O所含的原子数为NA | |
| C. | 标准状况下,16gO2所含的电子数为8NA | |
| D. | 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com