
| A. | 油脂属于脂类 | B. | 油脂都不能使溴水褪色 | ||
| C. | 油脂没有固定的熔沸点 | D. | 油脂是高级脂肪酸的甘油酯 |
科目:高中化学 来源: 题型:解答题
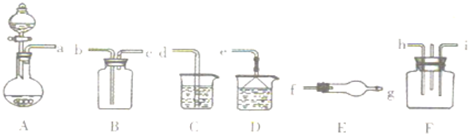
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:| 项目 | 苯 | 溴 | 溴苯 |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2可通过化合反应一步制得 | |
| B. | 不能用稀盐酸区别二氧化锰、氧化铜、还原铁粉三种黑色粉末 | |
| C. | 采用将MgSO4溶液直接蒸干的方法不能制备MgSO4固体 | |
| D. | 可通过电解熔融MgCl2来制取Mg,故也可通过电解熔融的AlCl3来制取Al |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳水化合物 | B. | 醇类 | C. | 氢气 | D. | 碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com