
| A. | 完全氧化56g Fe需要消耗氯气33.6 L | |
| B. | 7.8g Na2O2溶于100ml水,转移电子数为0.1NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9NA电子 |
分析 A.氯气的状态无法确定;
B.过氧化钠与足量水反应转移电子的物质的量等于反应的过氧化钠的物质的量;
C.三价铁离子不能氧化亚硫酸氢根;
D.根据铁的质量计算出物质的量,再计算出转移的电子数.
解答 解:A.氯气的状态无法确定,无法计算,故A错误;
B.7.8 g过氧化钠的物质的量为0.1mol,过氧化钠与足量水反应转移电子的物质的量为0.1mol,因此转移电子数为0.1NA,故B正确;
C.三价铁离子不能氧化亚硫酸氢根,不反应,故C错误;
D.16.8g Fe的物质的量为0.3mol,生成1molFe转移$\frac{8}{3}$mol电子,则生成0.3mol铁转移0.8mol电子,转移的电子数目为0.8NA,故D错误.
故选B.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO3>H2CO3 | B. | 熔沸点:HF>HCl | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:Na2CO3>CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
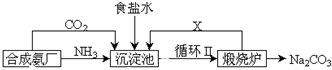
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

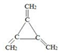 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,溶解度:Mg(OH)2>Fe(OH)3 |
| B | 向两份等体积等浓度的H2O2溶液中,分别滴入等浓度等体积CuSO4、KMnO4溶液,后者产生气体较多 | 证明KMnO4溶液的催化效率更高 |
| C | 测定相同物质的量浓度的硅酸钠 和碳酸钠溶液的PH,前者较大 | 证明非金属性:C>Si |
| D | 向FeCl3溶液中加入铁钉,溶液颜色变浅 | 证明FeCl3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3 | B. | CH≡CH与CH2=CH2 | ||
| C. | ${\;}_{8}^{16}$O与${\;}_{8}^{18}$O | D. | CH3-CH2-CH2-CH3与CH3-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )
铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )| A. | 闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气 | |
| B. | 若将两U形管中的溶液混合,混合液的质量分数仍为30% | |
| C. | 若再单独闭合S2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小 | |
| D. | 若再单独闭合S2,E、F电极上发生的反应与之前相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com