
【题目】常温下,下列物质的溶液pH>7的是
A.K2SO4B.NH4ClC.Na2CO3D.Cu(NO3)2
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体只有两种结构:含相同碳原子数,主链上也有4个碳原子的单烯烃(只含一个>C=C<的链烃) 其可能的结构有
A. 3种 B. 4 种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述不正确的是( )
A.标准状况下,22.4 L的CCl4中所含质子数为74 NA
B.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
C.12 g石墨晶体中含有的碳碳键数目为1.5 NA
D.分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有多种价态,将14.4 g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2 g铁的氧化物,则该铁的氧化物是( )
A. FeO B. Fe2O3
C. Fe3O4 D. FeO和Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种微粒的核外电子数相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子B.两种所带电荷数相同的离子
C.同一元素的原子和离子D.两种不同元素的原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 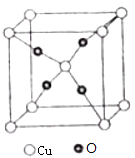
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境,实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO,制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH熔液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)滤液A中加入H2O2反应的离子方程式为__________________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是______________。
(3)下列试剂可作为Y试剂的是______________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
(4)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是____________________。
(5)由不溶物E生成溶液D的化学方程式为____________________________________。
(6)由溶液D制胆矾晶体包含的主要操作步骤是,蒸发浓缩、________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的记录不正确的是
A.纯净的氢气在氯气中安静的燃烧,发出苍白色火焰
B.红热的铜丝在氯气中燃烧,产生绿色的烟
C.红热的铁丝在氯气中燃烧,产生棕褐色的烟
D.将氯气通入硝酸银溶液中,生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com