
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.分析 方案一:(1)滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,关键是该沉淀剂能够与碳酸氢根离子反应生成沉淀;
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法,根据洗涤液中是否含有钡离子检验;
(3)沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,据此判断对测定结果的影响;
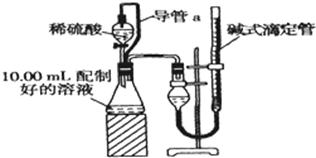
方案二:(1)由于碳酸盐与酸反应产生二氧化碳气体,瓶内压强增大,所以装置中导管a的作用是平衡压强、使液体顺利滴下;消除加入稀硫酸引起的体积误差;
(2)若撤去导管a,会导致硫酸的体积产生误差;
方案三:(1)碳酸钠、碳酸氢钠的混合液显碱性,应该用碱式滴定管量取;
(2)酚酞的变色范围是8.2~10.0,反应结束时溶液由红色突变为无色,据此判断滴定终点;
(3)根据反应H++CO32-=HCO3-计算出50 mL样品溶液中含有的碳酸钠的物质的量,然后计算出250mL样品溶液中含有的碳酸钠的物质的量,再根据m=nM计算出碳酸钠的质量,最后根据质量分数的表达式计算出样品中碳酸钠的质量分数.
解答 解:方案一:(1)A.CaCl2溶液只能与碳酸根反应转化为碳酸根沉淀,故A错误;
B.MgSO4溶液与HCO3-、CO32-均不反应,故B错误;
C.NaCl溶液与HCO3-、CO32-都不反应,故C错误;
D.Ba(OH)2溶液与HCO3-、CO32-都发生反应生成碳酸钡沉淀,故D正确;
故答案为:D;
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法,根据洗涤液中是否含有钡离子检验,取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未完成,
故答案为:取少量最后一次洗涤液,滴加Na2SO4溶液,如无沉淀,则沉淀已洗净,反之则未完成;
(3)如果此步中,沉淀未干燥充分就称量,则称量值偏大,由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小,故答案为:偏小;
方案二:(1)由于碳酸盐与酸反应产生二氧化碳气体,瓶内压强增大,所以装置中导管a的作用是平衡压强、使液体顺利滴下;消除加入稀硫酸引起的体积误差,故答案为:平衡压强、使液体顺利滴下,消除加入稀硫酸引起的气体体积误差;
(2)若撤去导管a,滴入硫酸到一定程度会产生压强,使测得气体体积偏大,
故答案为:偏大;
方案三:(1)溶液显碱性,因此应该用碱式滴定管量取,
故答案为:碱式滴定管;
(2)酚酞的变色范围是8.2~10.0,所以判断滴定终点的依据是由红色突变为无色,且30s不恢复,
故答案为:由红色突变为无色,且30s不恢复;
(3)反应达到终点时,发生的离子方程式为:H++CO32-=HCO3-,
则根据消耗盐酸的体积可知20.00ml可知,消耗碳酸钠的物质的量为:0.2000 mol/L×0.02000L=0.004mol,
则原混合物中碳酸钠的物质的量为:0.004mol×$\frac{250ml}{25ml}$=0.04mol,质量为:0.04mol×106g/mol=4.24g,
所以碳酸钠质量分数为:$\frac{4.24g}{5.0g}$×100%=84.8%,
故答案为:84.8.
点评 本题考查碳酸钠和碳酸氢钠混合物中碳酸钠含量测定的实验方案设计与评价,题目难度中等,明确化学实验基本操作方法及碳酸钠、碳酸氢钠的性质为解答此题关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
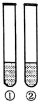 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( ) | 实验目的 | 试剂 | 试管中的物质 | |
| A | 浓度对硫酸的性质有影响 | Fe | ①稀硫酸;②浓硫酸 |
| B | 羟基对苯环活性有影响 | 饱和溴水 | ①苯;②苯酚 |
| C | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯;②甲苯 |
| D | 碳酸钠溶液碱性比碳酸氢钠溶液强 | 酚酞溶液 | ①碳酸钠溶液 ②碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a为H2S,SO2+2H++S2-→3 S↓十2H2O | |
| B. | a为Cl2,Ba2++SO2+2 H2O+Cl2→BaSO3↓+4H++2Cl- | |
| C. | a为NO2,4Ba2++4SO2+5H2O+NO3-→4 BaSO4↓+NH4++6 H+ | |
| D. | a为NH3,Ba2++SO2+2 NH3+2H2O→BaSO4↓+2NH4++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
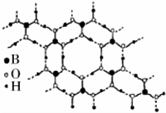 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | H3BO3分子的稳定性与氢键有关 | |
| B. | 含1mol H3BO3的晶体中有3mol氢键 | |
| C. | 分子中B、O最外层为8e-稳定结构 | |
| D. | 同层分子间的主要作用力是范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NH3 能与Cl2 生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| C. | NaHCO3 能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| D. | K2FeO4 能与水作用生成Fe(OH)3 胶体和O2,可用于净化自来水并杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发风能等洁净能源,减少使用化石燃料 | |
| B. | PM2.5表面积较大易吸附其他物质,对人体危害很大 | |
| C. | 雾霾严重时,中小学生应减少或停止户外活动 | |
| D. | 汽油标准由“国Ⅳ”提到“国 V”后,汽车不再排放氮氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用金属钠时,多余的钠应该置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在l00mL容量瓶内溶解并稀释至刻度线,得到0.50 mol/L氢氧化钠溶液 | |
| D. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 实验方案 |
| A | 证明其他条件不变时,增大反应物浓度,反应速率加快 | 常温下,对比等量铝粉分别与稀硫酸反应的反应速率 |
| B | 证明SO2具有氧化性 | 将SO2通入酸性KMnO4溶液中,观察溶液是否褪色 |
| C | 证明Ksp(AgCl)>Ksp(Ag2S) | 向2mL0.1mol•L-1AgNO3溶液中加入1mL0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| D | 证明“84”消毒液(含NaClO)的氧化能力随溶液pH减小而增强 | 将“84”消毒液滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快退去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
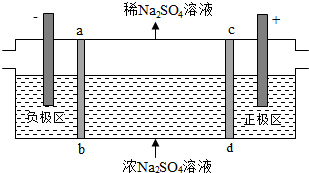
| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 负极反应为2H2O-4e-=O2+4H+,负极区溶液pH降低 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com