
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
![]()
(1)从三种不同分类标准回答,“铜绿”属于哪类物质? _。
(2)请写出铜绿与盐酸反应的化学方程式: 。
(3)写出B的化学式 。
(4)上述转化过程中属于化合反应的是 ,属于复分解反应的是 (填序号)。
(5)写出①反应的化学方程式 。
【答案】(1)铜盐、碳酸盐、碱式盐、盐、化合物(任意三种);(2)Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O;(3)CuO ; (4)①,②③;(5)2Cu+O2+CO2+H2O===Cu2(OH)2CO3。
【解析】
试题分析:(1)铜绿是Cu2(OH)2CO3,根据盐的分类,可以分为铜盐、碳酸盐、碱式盐、化合物等;(2)根据题中信息,和酸反应生成铜盐、CO2、H2O,因此反应方程式为:Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O;(3)反应④加热,使氢氧化铜分解成CuO,则B为CuO;(4)反应①为化合反应、反应②为复分解反应、反应③加入NaOH溶液发生复分解反应、反应④是分解反应、反应⑤是置换反应,因此化合反应是①,复分解反应为②③;(5)反应方程式为:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】医用化学杂志曾报道,有一种功能高分子材料为聚乙交酯纤维材料C,用这种功能高分子材料制成的手术缝合线比天然高分子材料的肠线好。它的合成过程如下:

(1)写出A的结构简式__________。
(2)写出由A制取B的化学方程式______________________________________________。
(3)可用作医用的高分子材料具备哪些特性?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
B.将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的实验装置可用于制取乙炔。请填空:


(1)图中,A管的作用是 。制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 , 乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中各项的排布规律,按此规律排布第23项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
A.C9H18 B.C9H118O2 C.C8H18 D.C8H16O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
Si3N4(s)+6CO(g)。⊿H =-1591.2 kJ/mol,则该反应每转移1mole—,可放出的热量为 。
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
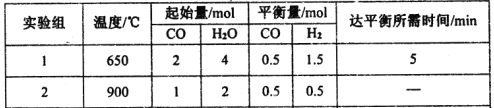
① 实验Ⅰ中,前5min的反应速率v(CO2)= 。
②900℃时该反应的平衡常数K =
③下列能判断实验Ⅱ已经达到平衡状态的是 。
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO) =v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
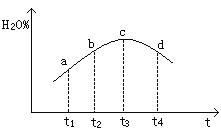
④若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示,则b点v正 v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是 。
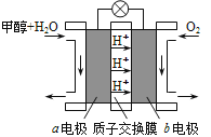
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时正极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式 。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为 (写化学式)。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。写出其离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联苄(![]() )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
(一)催化剂的制备:下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:

(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,_______接_______,_________接________,_________接________。
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3。你认为这样做是否可行__________(填“可行”或“不可行”),你的理由是________________。
(3)装置A中隐藏着一种安全隐患,请提出一种改进方案:_____________。
(二)联苄的制备
联苄的制取原理为:![]()
反应最佳条件为n(苯) :n(1,2-二氯乙烷)=10 :1,反应温度在60-65℃之间。
实验室制取联苄的装置如下图所示(加热和加持仪器略去):
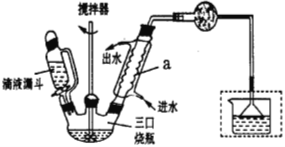
实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.7 mL1,2-二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2 g。
相关物理常数和物理性质如下表
名称 | 相对分子质量 | 密度/(gcm-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
无水氯化铝 | 133.5 | 2.44 | 178(升华) | 遇水水解,微溶苯 | |
联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
(4)仪器a的名称为______________,和普通分液漏斗相比,使用滴液漏斗的优点是_________。
(5)洗涤操作中,水洗的目的是_____________;无水硫酸镁的作用是______________。
(6)常压蒸馏时,最低控制温度是________________。
(7)该实验的产率约为______________。(小数点后保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com