
����Ŀ����Ҫ�����������գ�
��1�����и��������밴Ҫ�������գ�
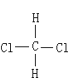
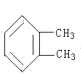
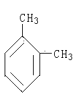
��H��D ��O2��O3 ���������뻷���� ��C2H6��CH3CH2CH2CH3 ��C2H4��C3H6 ��CH2�TCHCH�TCH2��CH![]() CH ��Һ�������� ���Ȼ��������� ��
CH ��Һ�������� ���Ȼ��������� ��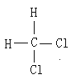 ��
�� ��
�� ��
��
����ͬ�����������_______ ������ͬλ�ص���_________ ������ͬ�����ʵ���___________������ͬϵ�����__________ ��
��2��ij�л������ʽΪC5H12�����л��������ֻ��һ����ͬ��ѧ�������⣬�л���Ľṹ��ʽΪ___________��
���𰸡��� �� �ߢ�� �� 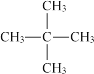
��������
��1��ͬ�������壺��ͬ��Ԫ����ɽṹ��ͬ�ĵ��ʣ�����ͬ�������嶨����Ǣڣ�
ͬλ�أ���������ͬ����������ͬͬ��Ԫ�ز�ͬԭ�ӵĻ��ƣ����϶�����Ǣ٣�
Һ��������Һ����õ��ģ����Һ������������ͬ�����ʣ��������Ȼ�������ˮ�����ڻ����Ȼ������ڴ��������Ȼ�����������ͬ�����ʣ�����Ŀռ乹��Ϊ�������壬���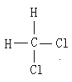 ��
��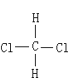 ����ͬ�����ʣ����ռ乹��Ϊƽ���������Σ�
����ͬ�����ʣ����ռ乹��Ϊƽ���������Σ�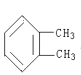 ��
�� ����ͬ�����ʣ��������ͬ�����ʵ��Ǣߢ�⣻
����ͬ�����ʣ��������ͬ�����ʵ��Ǣߢ�⣻
ͬϵ���ǽṹ���ƣ�������������������CH2��ԭ���ŵ��л������ͬϵ����Ǣܣ�
��2�����л���ֻ��һ����ͬ��ѧ������H�������л���Ľṹ��ʽΪ ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����N2��H2�ϳ�NH3���Ʊ�H2�辭�ಽ��ɣ�������ˮú����CO��H2���任���Ǵ���H2�Ĺؼ�һ����
��1��ˮú���任��CO��g��+ H2O��g��![]() CO2��g�� + H2��g�����÷�Ӧ��H = +41 kJ/mol����41 kJ/mol��
CO2��g�� + H2��g�����÷�Ӧ��H = +41 kJ/mol����41 kJ/mol��
�� ƽ�ⳣ��K���¶ȱ仯���£�
�¶�/�� | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
���з�����ȷ����__________��
a. ˮú���任��Ӧ��H��0
b. ����ѹǿ���������CO��ƽ��ת����
c. ����ˮ����Ũ�ȣ�����ͬʱ����CO��ƽ��ת���ʺͷ�Ӧ����
�� �¶�ΪT1ʱ�����ݻ�Ϊ2 L ���ܱ������ס����зֱ����һ������CO��H2O��g����
����������£�
���� | �� | �� | ||
��Ӧ�� | CO | H2O | CO | H2O |
��ʼʱ���ʵ�����mol�� | 1.2 | 0.6 | 2.4 | 1.2 |
ƽ��ʱ���ʵ�����mol�� | 0.8 | 0.2 | a | b |
�ﵽƽ���ʱ�䣨min�� | t 1 | t 2 | ||
��. �������У���Ӧ��t1 min �ڵ�ƽ����Ӧ����v��H2��=_____mol/��L��min����
��. �������У�ƽ��ʱ����Ӧ�������仯Ϊ_____kJ��
��. T1ʱ����Ӧ��ƽ�ⳣ��K��= ______��
��. ��������a =______mol��
��2����ˮΪ���ռ��ѳ�CO2������ʧȥ��������ʱ��ͨ������ʹ���ռ��������û�ѧ����ʽ��ʾ�����������̣�___________________________________��
��3��2016���ҹ�ij�����Ŷ�������Ĥ��һ�������N2��H2������ԭ����ͼ��ʾ����������N2��O2�����ʵ���֮�Ȱ�4:1�ƣ���
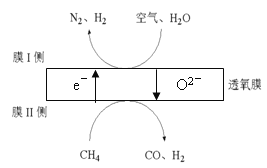
�� ��ԭ���õ�������_______��
�� Ĥ������ĵ缫��Ӧʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����Ͻ���һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ġ���Ҫ�������£�
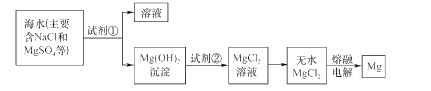
(1)Ϊ��ʹMgS04ת��ΪMg(OH)2���Լ��ٿ���ѡ��____���ѧʽ����
(2)�����Լ��ٺ��ܹ�����õ�Mg(OH)2�����ķ�����____��
(3)�Լ��ڿ���ѡ�� ___���ѧʽ����
(4)��ˮMgCl2������״̬�£�ͨ�������Mg��Cl2���÷�Ӧ�Ļ�ѧ����ʽΪ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���137�ǽ���蘆�ͬλ��֮һ���롰��235��ͬ���ڷ��������ʡ����ж�![]() ��
��![]() ������ȷ����(����)
������ȷ����(����)
A. Cs��U����������ֵΪ37
B. Cs��U����������ֵΪ98
C. �137�ĵ�������82
D. ��Ԫ�ص����ԭ��������235
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ��ṹ�е�һС���֣���~���Ƕ�����Ԫ�أ������ж���ȷ���ǣ� ��

A. ԭ�Ӱ뾶���ף�������
B. �����ԣ��ף���
C. ������Ǣ�A��Ԫ��
D. ������������Ӧ��ˮ���������H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ڷ��ȷ�Ӧ����(����)
A.��ʯ��ʯ����ʯ��B.����ʯ���м�ˮ
C.Ũ�����ϡ��D.��������������Ƶķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ����ȼ�ϵ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ��������������ȷ����

A. a�缫�Ǹ���
B. b�缫�ĵ缫��ӦΪ��4OH����4e��====2H2O+O2��
C. ����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
D. ����ȼ�ϵ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������8�֣����в���Ԫ�ص�������ԭ��(�����)�ṹ���±���
Ԫ�ر�� | Ԫ��������ԭ��(�����)�ṹ |
T | �����������Ǵ�����������3�� |
X | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��������Ԫ�صļ������а뾶��С |
(1)д��Ԫ��T��ԭ�ӽṹʾ��ͼ ��
(2)Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________(�����)��
a��Y���ʵ��۵��Z���ʵ�
b��Y�Ļ��ϼ۱�Z��
c��Y������ˮ��Ӧ��Z���ʾ���
d��Y����������ˮ����ļ��Ա�Zǿ
(3)T��X��Y��Z��������Ԫ�����γɼ������Ӽ����зǼ��Թ��ۼ��Ļ����д���û�����ĵ���ʽ��_____ _________��
(4)Ԫ��T����Ԫ�ؿ��γ�һ��18���ӵĻ�����Q��Ԫ��X����Ԫ��Ҳ�ܰ�ԭ�Ӹ�����Ϊ1��2�γ�һ��18���ӻ�����W��Q��W����������ԭ��Ӧ������X���ʺ�T����һ���⻯�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������Ҫ����ԭ�ϣ����Ĵ�����Դ���ڵõ������Ʒͬʱ�����˴�����������ˮ��������ij�����ŷŵķ�ˮ�к���Cu2����Fe2����Hg2����H�������ӣ�ij��ѧС��Ϊ�˳��������Դ�ͱ��������������շ�ˮ�е�ͭ����ͬʱ�õ��̷����������������ʵ�鷽����
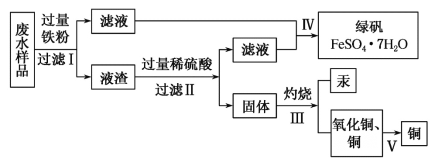
��1�������������ƾ��ơ���������������������������ƿ���ձ�������̨�ȣ���ɲ������ʵ���������Ҫѡ��IJ���������__________��Ƽ�ʵ������̷��Ƿ���ʣ�������IJ�����__________��
��2��������м���������۵�Ŀ����__________���������__________(��ܡ����ܡ�)������������ᡣ
��3������V��������ͭ��ȡͭ���������ַ�����
�����ף�����������ԭ����ͭ��
�����ң�����һ����̼��ԭ����ͭ��
������������̿�ۻ�ԭ����ͭ��
���������Ƚ�����ͭ����ϡ���ᣬȻ�������������ۡ����ˣ��ٽ��������ڹ�����ϡ���ᣬ�ٹ��ˡ�ϴ�ӡ���ɡ�
�Ӱ�ȫ�Ƕȿ��ǣ�����__________���ã��Ӳ�Ʒ���ȿ��ǣ�����__________���á�
��4��д����������漰��Ӧ�����ӷ���ʽ��__________��������õ��̷��IJ�������Ũ��__________��__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com