
���� ��1��ʵ�����ü���NH4Cl��Ca��OH��2��������ķ�����ȡ����������CaCl2��ˮ���ʿ���д����ѧ����ʽ��
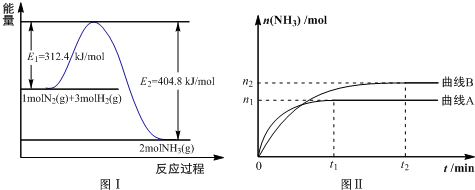
��2��N2��g��+3H2��g���T2NH3��g����H=-92.4KJ/mol
A������ͼ���������Ӧ�ʱ��H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol��
B��ʹ�ô����ı䷴Ӧ���ʽ��ͷ�Ӧ�Ļ�ܣ�
C���¶�Խ��ƽ��������У���ҵ�����з�Ӧ������������Ч�ʺ;���Ч��ͣ�
D��ͼ2�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵ�������ȹ���ƽѹǿ��ϰ������ʵ���������
E��ͼ2�Dz�ͬ�¶��·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵ�ȹ���ƽ�¶ȸߣ���ϰ������ʵ���������
F���÷�Ӧ�¶Ȳ��䣬��Ӧ��ƽ�ⳣ�����¶ȱ仯������
G��������A�����£���Ӧ�ӿ�ʼ��ƽ�⣬���㰱���ķ�Ӧ���ʣ����ݷ�Ӧ����֮�ȵ���ϵ��֮�ȣ��õ�����N2��ƽ������=$\frac{��c}{��t}$��
��3�����ݻ�ѧƽ������ʽ��ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ���������ƽ�ⳣ������ʼ��Ϊamol N2��bmol H2��cmol NH3��a��b��c����Ϊ�㣩����ʹƽ�������и����ʵ�������ԭƽ����ͬ������ת��Ϊ��ʼ����������Ч��������
��4������ȼ���ȵĸ�����1mol��ȼ����ȫȼ�������ȶ�������ų���������д�Ȼ�ѧ����ʽ������ԭ���ԭ�����������ԭ��Ӧ����������д���缫��Ӧ�����ݵ缫����ʽ��������ų�1mol N2�����ṩ�ĵ��ܣ���������Ч�ʣ�
��� �⣺��1������NH4Cl��Ca��OH��2��������ķ�����ȡ��������ӦΪ2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$2NH3��+CaCl2+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$2NH3��+CaCl2+2H2O��
��2��A������ͼ���������Ӧ�ʱ��H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol����A��ȷ��
B��ʹ�ô����ı䷴Ӧ���ʽ��ͷ�Ӧ�Ļ�ܣ�E1��С����B����
C��Ϊ�����ת���ʣ���Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ��������У���ҵ�����з�Ӧ������������Ч�ʺ;���Ч��ͣ���C����
D��ͼ2�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵ�������ȹ���ƽѹǿ��pA��pB ��ѹǿԽ�������ʵ�������D����
E��ͼ2�Dz�ͬ�¶��·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵ�ȹ���ƽ�¶ȸߣ�TA��TB����E��ȷ��
F����Ӧ��ƽ�ⳣ�����¶ȱ仯���÷�Ӧ�¶Ȳ��䣬ƽ�ⳣ�����䣬ѹǿ�ı䲻Ӱ��ƽ�ⳣ����ͼ����Ӱ����������DE�������¶ȸı䣬TA��TB���¶�Խ��ƽ��������У�ƽ�ⳣ��KA��KB����F��ȷ��
G��������A�����£���Ӧ�ӿ�ʼ��ƽ�⣬V��NH3��=$\frac{{n}_{1}mol}{2L{��t}_{1}min}$=$\frac{{n}_{1}}{{2t}_{1}}$mol/��L•min������Ӧ����֮�ȵ���ϵ��֮�ȣ�����N2��ƽ������=$\frac{1}{2}$V��NH3��=$\frac{{n}_{1}}{4{t}_{1}}$mol/��L•min������G��ȷ��
�ʴ�Ϊ��AEFG��
��3��һ���¶��£���һ���ݻ�Ϊ2L���ܱ�������ͨ��2molN2��7molH2��������ƽ������ʽ��ʽ���㣬�赪���������ʵ���Ϊx��
N2��g��+3H2��g���T2NH3��g����
��ʼ����mol/L�� 2 7 0
�仯����mol/L�� x 3x 2x
ƽ������mol/L�� 2-x 7-3x 2x
�ﵽƽ��ʱ��������ڵ�ѹǿΪ��ʼʱ��$\frac{7}{9}$�����������ʵ���֮�ȵ���ѹǿ֮�ȣ�2-x+7-3x+2x=$\frac{7}{9}$��2+7�������x=1��
ƽ�ⳣ��K=$\frac{��\frac{2}{2}��^{2}}{\frac{1}{2}����\frac{4}{2}��^{3}}$=0.25��
��ʼ��Ϊamol N2��bmol H2��cmol NH3��a��b��c����Ϊ�㣩����ʹƽ�������и����ʵ�������ԭƽ����ͬ������ת��Ϊ��ʼ����������Ч����
N2��g��+3H2��g���T2NH3��g����
��ʼ����mol/L�� a b c
ת���� a+$\frac{c}{2}$ b+$\frac{3c}{2}$ 0
��a+$\frac{c}{2}$=2��b+$\frac{3c}{2}$=7����3a-b=-1����Ϊb-3a=1��
��Ϊƽ��ʱ������Ũ��Ϊ2mol/L��Ҫʹ��Ӧ��ȫ������У�������Ũ��Ϊ4mol/L��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��2��c��4��
�ʴ�Ϊ��0.25��b-3a=1��2��c��4��
��4��H2��g����ȼ����Ϊ285.8kJ/mol����ʾNH3��g��ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽΪ��NH3��g��+$\frac{3}{4}$O2��g��=$\frac{1}{2}$N2��g��+$\frac{3}{2}$H2O��l����H=-382.5KJ/mol��
�ڰ�ȼ�ϵ���У�����ʧȥ���ӣ��ڸ�����Ӧ���������ɵ����������õ����ӣ���������Ӧ�������ڼ��Խ����У����ݵ���غ��д���缫��ӦʽΪ��2NH3-6e-+6OH-�TN2+6H2O�����ݰ���ȼ���ȵķ���ʽ��֪������1mol�������Էų�765KJ�����������Ը�ȼ�ϵ�ص�ʵ��Ч��Ϊ$\frac{460}{765}$��100%=60.1%��
�ʴ�Ϊ��NH3��g��+$\frac{3}{4}$O2��g��=$\frac{1}{2}$N2��g��+$\frac{3}{2}$H2O��l����H=-382.5KJ/mol��2NH3-6e-+6OH-�TN2+6H2O�� 60.1%��
���� ���⿼�����Ȼ�ѧ����ʽ��д��������ѧƽ��Ӱ�����ط����жϣ�ƽ�ⳣ������Ӧ�ã���Чƽ��״̬�ķ���������ԭ���ԭ����Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | ���ڵ��������� | C�� | ʳ��ˮ | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 N2+4NH3��Ϊ�����µķֽ⣬�ɲ�ȡ�ĺ�����ʩ�н��ͷ�Ӧ�¶ȣ���дһ�֣���
N2+4NH3��Ϊ�����µķֽ⣬�ɲ�ȡ�ĺ�����ʩ�н��ͷ�Ӧ�¶ȣ���дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������������β���Ĵ�����������������߿������� | |
| B�� | ���ٻ�ʯȼ�ϵ�ʹ�ã������ڽ��Ϳ�����PM2.5�ĺ��� | |
| C�� | ʳƷ��װ���г�����С������ʯ�ң�Ŀ���Ƿ�ֹʳƷ�������� | |
| D�� | ҽ�þƾ����õ�����ֲ��;������Ƴɣ�Ũ��ͨ����75% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 N��P��As��Ga��Cr��Ԫ�ػ���������࣬������Ҫ���о���ֵ��Ӧ�ü�ֵ����ش��������⣺
N��P��As��Ga��Cr��Ԫ�ػ���������࣬������Ҫ���о���ֵ��Ӧ�ü�ֵ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2CH3CH2OH+2Na��2CH3CH2ONa+H2����ȡ����Ӧ�� | |
| B�� | CH2�TCH2+H2O$\stackrel{����}{��}$CH3CH2OH���ӳɷ�Ӧ�� | |
| C�� | CH3COOH+CH3CH2OH$?_{��}^{ŨH_{2}SO_{4}}$CH3COOCH2CH3+H2O��ȡ����Ӧ�� | |
| D�� | 2CH3CH2OH+O2$��_{��}^{����}$2CH3CHO+2H2O���ӳɷ�Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3��Һ���ռ���Һ��Ӧ����n��OH-����n��Al3+��=7��2ʱ��2Al3++7OH-�TAl��OH��3��+AlO2-+2H2O | |
| B�� | CuCl2��Һ��NaHS��Һ��Ӧ����n��CuCl2����n��NaHS��=1��2ʱ��Cu2++2HS-�TCuS��+H2S�� | |
| C�� | Cl2��FeBr2��Һ��Ӧ����n��Cl2����n��FeBr2��=1��1ʱ��2Fe2++4Br-+3Cl2�T2Fe3++2Br2+6Cl- | |
| D�� | Fe��ϡ���ᷴӦ����n��Fe����n��HNO3��=1��2ʱ��3Fe+2NO3-+8H+�T3Fe2++2NO��+4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��Ӧ������ӷ���ʽΪ2OH-+Al2O3�T2AlO2-+H2O | |
| B�� | ����a�����ݰ�����ͨ�����CO2�����ˡ�ϴ�ӡ����� | |
| C�� | ����bΪ�������״̬��Al2O3����CO��ԭAl2O3 | |
| D�� | ����b���պ�������Ӧ�����ڹ�ҵ��ұ����Ӧ�Ľ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com