
【题目】锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程:
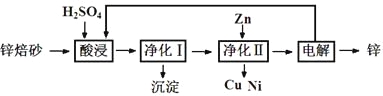
(1)酸浸时需要240 mL 4 mol·L-1稀H2SO4,用18.4 mol·L-1浓硫酸配制该稀H2SO4过程
中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。
(2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。
(3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。
(4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。
(5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。
【答案】(1)250 mL容量瓶、玻璃棒;Cu2+、Fe2+
(2)H2O2+2Fe2++2H+=2Fe3++2H2O(2分);Fe(OH)3(1分)
(3)取最后洗涤液少量,滴加BaCl2,若无白色沉淀,则洗干净(2分);
H2SO4、ZnSO4(各1分,共2分)
(4)78g(2分)(5)最终得到的产品中含Cu、Ni杂质(2分)
【解析】试题分析:(1)锌焙砂经被烧后所得的产物,主要含氧化锌、硫酸锌(有少量FeO、CuO、NiO杂质),加入硫酸酸化,可生成硫酸锌、硫酸铜、硫酸镍以及硫酸亚铁等,因此酸浸得到的溶液中除Zn2+外,还含有的金属阳离子有Cu2+、Fe2+、Ni2+等,用浓硫酸配制稀硫酸需要的仪器有:量筒量取浓硫酸、烧杯用来溶解浓硫酸、玻璃棒搅拌、引流等、胶头滴管定容以及250mL容量瓶等;
(2)净化Ⅰ操作需要加入H2O2溶液并控制溶液的pH在4左右,亚铁离子被双氧水氧化成铁离子,反应的离子方程式为H2O2 + 2Fe2+ + 2H+=2Fe3+ + 2H2O,控制溶液pH,使Fe3+转化为Fe(OH)3沉淀;
(3)净化Ⅱ得到的Cu、Ni可吸附溶液中的硫酸根离子,检验是否洗涤干净,可取最后一次洗涤液于小试管中,滴加硝酸酸化的BaCl2溶液,如无沉淀生成,说明洗涤干净,通过制取金属锌的流程图示可以知道,可以循环利用的物质除锌外,含有硫酸、硫酸锌;
(4)13.44L(标准状况下) 氧气n=V/Vm=13.44/22.4L/mol=0.6mol,转移电子0.6mol×4=2.4mol,生成1mol锌需转移2mol电子,所以在阴极析出锌的质量为:2.4mol/2×65g/mol=78g;
(5)上述工艺中,如果不设计“净化Ⅱ”,溶液中含有Cu2+、Ni2+,电解会造成的结果是最终得到的产品中含Cu、Ni杂质。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
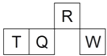
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐中,T元素只能存在于阳离子中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol
O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol
②CO(g)+![]() O2(g)=CO2(g) △H=-b kJ/mol
O2(g)=CO2(g) △H=-b kJ/mol
③H2(g)+![]() O2(g)=H2O(g) △H=-c kJ/mol
O2(g)=H2O(g) △H=-c kJ/mol
④H2(g)+![]() O2(g)=H2O(l) △H=-d kJ/mol
O2(g)=H2O(l) △H=-d kJ/mol
下列叙述不正确的是
A. 由上述热化学方程式可知d>c
B. H2的燃烧热为d kJ/mol
C. CH3OH(g)=CO(g)+2H2(g) △H=(b+2c-a)kJ/mol
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是
A. 石灰水和稀盐酸混合
B. 小苏打溶液和柠檬水混合
C. 人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D. 氯化钠溶液和蔗糖水混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是_______________。
②用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是___________________。
(2)完成下列化学方程式:体现N元素的还原性:
a. 汽车尾气中产生的NO:N2+O2 ![]() 2NO。
2NO。
b. 氨的催化氧化:_______________________。
(3)NO2 易溶于水。标准状况下将体积为V mL的试管充满NO2后倒扣在水中,见下图。
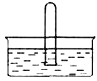
① NO2溶于水的化学方程式是_________。
② 使试管中NO2恰好完全被水吸收需要缓慢通入氧气,通入标准状况下氧气的体积为__________。最终试管中所的硝酸的物质的量浓度为_____________。
③ 为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是_______________.
(4)写出除掉Fe2O3中的SiO2的离子方程式____________________________
写出制取漂白粉的化学方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
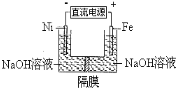
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B.若隔膜为阴离子交换膜,则OH-自右向左移动
C.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn(OH)2的溶度积常数为1.2×10-17(mol·L-1)3,则Zn(OH)2在水中的溶解度为
A.1.4×10-6 mol·L-1 B.2.3×10-6 mol·L-1
C.1.4×10-9 mol·L-1 D.2.3×10-9 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. “84”消毒液可用作漂白剂 B. 过氧化钠可用作供氧剂
C. 医院常用90%的酒精作消毒剂 D. 活性铁粉可用作抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn﹣的核外电子排布相同,则下列关系式中正确的是( )
A.a=b+m+n
B.a=b﹣m+n
C.a=b+m﹣n
D.a=b﹣m﹣n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com