


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、若b、c点的平衡常数分别为K1、K2,则K1>K2 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、若平衡后保持温度不变,压缩容器体积平衡一定不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
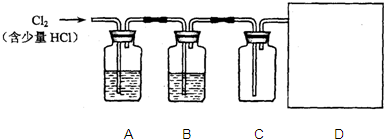
| 实验步骤 | 预期现象和相应结论 | |
| i |  试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸. |
①若 ②若 |
| ii | 若“假设一”不成立,向实验步骤i反应后的试管A中滴入2滴 |
①若 中的②分析,则“假设三”成立. ②若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
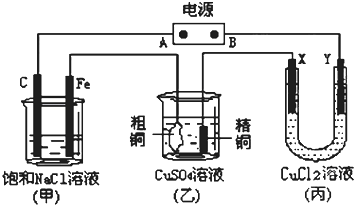
查看答案和解析>>
科目:高中化学 来源: 题型:
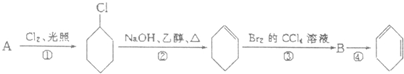
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、最外层电子数为8的微粒均是稀有气体元素的原子 |
| C、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D、在周期表中金属和非金属的分界线附近寻找制备半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
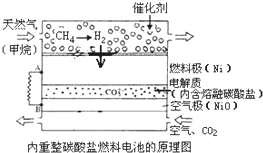 以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )| A、外电路电子流动方向:由A流向B |
| B、空气极发生反应的离子方程式是O2+4e-=2O2- |
| C、以此燃料电池为电源电解精炼铜,当电路有0.6mol e?转移,有19.2g精铜析出 |
| D、负极反应为H2-2e-+CO32-=CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
| B、金属钾与水反应:K+2H2O═K++2OH-+H2↑ |
| C、碳酸氢钙溶液中加入少量氢氧化钠溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com