
����Ŀ��������Ԫ�����ڱ���һ���֣��ش������й����⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
1 | �� | ||||||
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� | �� | ||
4 |
|
|
��1����ˮ��Ӧ����ҵĽ���Ԫ����_____��Ԫ�ع��ɵ����ȶ���̬�⻯��Ļ�ѧʽ��_________���ۡ��ܡ���Ԫ��ԭ�Ӱ뾶�ɴ�С��_____________����Ԫ�ط��ű�ʾ����
��2��д��Ԫ�آߵĵ����������������ˮ���ﷴӦ�����ӷ���ʽ______________.
��3���ڡ�������Ԫ���γ�ij���廯�����ǵ�������ЧӦ����Ҫԭ�û�����ĵ���ʽΪ_____________��Ԫ�آ��γ�һ�ּ���������õ���ʽ��ʾ�ü�����������γɹ���______________________��
��4���ڵĵ�����������������ˮ�����Ũ��Һ��Ӧ��ѧ����ʽ____________________.
���𰸡� K HF Si>N>O 2Al+2OH-+2H2O=2AlO2-+3H2�� ![]() �����Ƶ���ʽ�γɹ��� C+2H2SO4��Ũ��
�����Ƶ���ʽ�γɹ��� C+2H2SO4��Ũ��![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
�����������⿼��Ԫ�����ڱ��С�λ���ԡ�Ӧ�ã���1����ˮ��Ӧ����ҵĽ�����˵��������ǿ��ͬ������ϵ��½�������ǿ��ͬ���ڴ������ҽ����Լ������������Ԫ���н�������ǿ��K����̬�⻯�����ȶ���˵���ǽ�������ǿ��ͬ������ϵ��·ǽ����Լ�����ͬ���ڴ������ҷǽ�������ǿ�����ǽ�������ǿ��Ԫ����F�����⻯����HF��ͬ���ڴ������Ұ뾶��С��ͬ������ϵ��°뾶����Si>N>O����2���ߵĵ�����Al��������������Ӧˮ������NaOH�����ӷ�Ӧ��2Al��2OH����2H2O=2AlO2����3H2������3���ڢ��γɵĻ�������CO2�����ڹ��ۻ����̼ԭ�Ӻ���ԭ�ӹ���2�����Ӷԣ�����ʽΪ![]() ��NaԪ�����γ������������Na2O��Na2O2�������������Ǽ�����������γɹ��̣�
��NaԪ�����γ������������Na2O��Na2O2�������������Ǽ�����������γɹ��̣�![]() ����4���ڵĵ�����C���������������Ӧˮ������H2SO4������Ũ�����ǿ�����ԣ���Ӧ����ʽΪC��2H2SO4(Ũ)
����4���ڵĵ�����C���������������Ӧˮ������H2SO4������Ũ�����ǿ�����ԣ���Ӧ����ʽΪC��2H2SO4(Ũ) ![]() CO2����2SO2����2H2O��
CO2����2SO2����2H2O��


 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������õ���ֱ�ӻ����Ƶõ���
A. CuCl2 B. FeCl2 C. MgCl2 D. Fe3O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ұ���������Һʱ��ʹ����ɫ����ƿ����
A. ��������Һ B. ���Ը��������Һ C. ��ˮ D. ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵����ȷ����
A�����ڡ���ά�ء���ȩ��֬���Ǻϳɲ���
B�����ͺ�ֲ���Ͷ��ǻ�����Ҫ�ɷ���������
C���������������л��ᣬ�����ܱ����Ը��������Һ����
D�������ǡ����ǡ�������һ�������¶��ɷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[�л���ѧ����]H��һ�����ϵijɷ�֮һ����ṹ�к���������Ԫ����G�Ľṹ��ʽΪ![]() ��H�ĺϳ�·�����£����ֲ���ͷ�Ӧ������ȥ����
��H�ĺϳ�·�����£����ֲ���ͷ�Ӧ������ȥ����
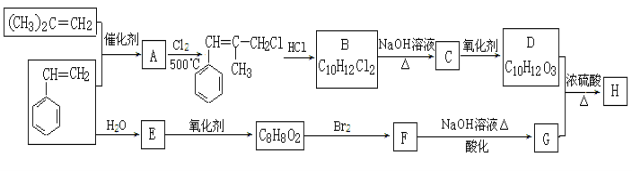
��֪���� B�к˴Ź�������ͼ��ʾ��������6�ֲ�ͬ��������ԭ�ӡ�
��![]()
��D��G��ͬϵ��
��1����ϵͳ����������(CH3)2C��CH2 ��
��2��A��B��Ӧ�������漰�ķ�Ӧ������ ��
��3��G�����к��������ŵ������� ��
��4��д��B����������������Һ�ڼ��������·�Ӧ�Ļ�ѧ����ʽ�� ��
��5��д��F�Ľṹ��ʽ: ��
��6��ͬʱ��������3������������FeCl3��Һ������ɫ��Ӧ�����ܷ���ˮ�ⷴӦ����������������ȡ������G��ͬ���칹���� �֣������������칹�������к˴Ź�������Ϊ5����Ϊ ��д�ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч����������Ⱦ�������ᳫʹ�������Դ���������������Դ����
A. ú B. ���� C. ˮ�� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�SO2(g����2CO(g��![]() 2CO2(g����S(l�� ��H<0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
2CO2(g����S(l�� ��H<0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
A��ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B��ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C��ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת����
D�������������䣬ʹ�ò�ͬ�������÷�Ӧ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м������ʵķ����ܴﵽĿ�ĵ���
A�ð�ˮ�����ð�ˮ����MgCl2��Һ��AlCl3��Һ
A. �ó���ʯ��ˮ����Na2CO3��Һ��NaHCO3��Һ
B. ��KSCN��Һ����FeCl3��Һ��FeCl2��Һ
C. �õ�����Һ����ӵ��κ�δ�ӵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���HCO3����SO32����CO32����CH3COO���������ӣ��������м���������Na2O2����Һ������Ũ�Ȼ������ֲ�����ǣ� ��
A.CH3COO��
B.SO32��
C.CO32��
D.HCO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com