
 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小分析 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素,D原子核外电子有8种不同的运动状态,则D为氧元素,C的氧化物是导致酸雨的主要物质之一,且C的原子序数小于D,所以C为氮元素,E的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1,则E为铬元素,F元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,所以F为铜元素,A与其余五种元素既不同周期也不同主族,所以A为氢元素,据此答题.
解答 解:在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,B的一种核素在考古时常用来鉴定一些文物的年代,则B为碳元素,D原子核外电子有8种不同的运动状态,则D为氧元素,C的氧化物是导致酸雨的主要物质之一,且C的原子序数小于D,所以C为氮元素,E的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1,则E为铬元素,F元素的基态原子最外能层只有一个电子,其它能层均已充满,则F原子外围电子排布为3d104s1,所以F为铜元素,A与其余五种元素既不同周期也不同主族,所以A为氢元素.
(1)E为铬元素,基态E原子的价电子排布为3d54s1,故答案为:3d54s1;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N;
A与C形成NH3分子,分子中N原子形成3个N-H、含有1对孤对电子,故N原子杂化类型为sp3,分子的立体结构为三角锥形;
C的单质为N2,化合物CO是等电子体,二者结构相似,CO分子中C原子与O原子之间形成三对共用电子对,故CO的电子式为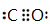 ;
;
H2O形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小,
故答案为:C<O<N;sp3;三角锥形;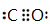 ;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;
;水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小;
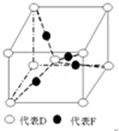
(3)根据晶胞的结构图可知,晶胞中含有氧原子数为1+8×$\frac{1}{8}$=2,铜原子数为4,所以该化合物的化学式为Cu2O,晶胞质量为(4×$\frac{64}{{N}_{A}}$+2×$\frac{16}{{N}_{A}}$)g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为$\frac{4a}{\sqrt{3}}$cm,所以体积为($\frac{4a}{\sqrt{3}}$cm)3cm3,该晶体的密度为(4×$\frac{64}{{N}_{A}}$+2×$\frac{16}{{N}_{A}}$)g÷($\frac{4a}{\sqrt{3}}$cm)3=$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:Cu2O;$\frac{27\sqrt{3}}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化轨道、等电子体、氢键度物质性质的影响、晶胞的计算等,中等难度,元素推断是解题的关键,需要学生具备扎实的基础,(3)中注意利用均摊法计算晶胞质量,关键是计算晶胞体积,需要学生具备一定的数学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 焦糖烯能使溴水褪色 | |
| B. | “半成品碳”是碳元素的一种新单质 | |
| C. | 蔗糖溶液与新制的氢氧化铜悬浊液混合加热有砖红色沉淀生成 | |
| D. | 焦糖烯是一种新型的烯经 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 | |
| B. | 直径接近于2.5×10-6m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 汽油发动机工作时会产生一定量的NO和CO,采用三元催化装置可以减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自发反应一定是熵增大,非自发反应一定是熵减小或不变 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| C. | pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com