
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ④ | ⑤ | ⑧ | ⑨ | |||
| 4 | ③ | ⑩ | (11) | |||||
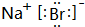 ,K元素焰色反应呈紫色,故答案为:
,K元素焰色反应呈紫色,故答案为: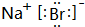 ;紫;
;紫;

科目:高中化学 来源: 题型:
| A、Cl-先沉淀,当CrO42-开始沉淀时,Cl-已沉淀完全 |
| B、CrO42-先沉淀,当Cl-开始沉淀时,CrO42-已沉淀完全 |
| C、Cl-先沉淀,当CrO42-开始沉淀时,Cl-尚未沉淀完全 |
| D、CrO42-先沉淀,当Cl-开始沉淀时,CrO42-尚未沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别将Na2SO3、Fe2(SO4)3、Ca(HCO3)2、CuCl2溶液蒸干,都不能析出原溶质的晶体 |
| B、草木灰(K2CO3)与铵态氮肥混合施用,会降低氮肥的肥效 |
| C、NaHCO3水解的离子方程式为HCO3-+H2O?CO32-+H3O+ |
| D、配制FeCl2溶液时,加入盐酸是防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、干电池是一种将化学能转变为电能的装置 |
| B、用普通干电池作电源,惰性材料做电极电解足量硫酸铜溶液时,当溶液中有0.8mol硫酸生成时,阴极析出标准状况下的气体体积为8.96L |
| C、步骤③:电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| D、步骤①:每析出12.8g S沉淀,共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学变化都伴随着能量的变化 |
| B、任何反应中的能量变化都表现为热量变化 |
| C、伴有能量变化的物质变化都是化学变化 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②③ |
| C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L SO3所含的分子数为0.5 NA |
| B、1molCl2参加氧化还原反应,转移的电子数目一定是2 NA |
| C、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA |
| D、46 g二氧化氮和四氧化二氮混合气体中含有的原子数为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com