
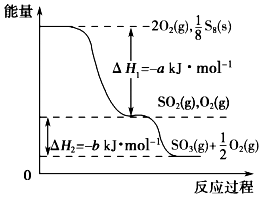
 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
分析 A.依据图象分析1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.1 mol SO2和0.5molO2反应生成1molSO3(g)时可释放出 b kJ 的热量;
C、SO2分子中硫氧键的键能为dkJ•mol-1,O=O键的键能为ekJ•mol-1,结合反应热等于反应物的键能总和减去生成物键能总和计算;
D、反应释放热量的多少与外界条件无关,只与始态和终态有关.
解答 解:A.依据图象分析1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,则S8(s)的燃烧热△H=-8akJ•mol-1,故A错误;
B.1 mol SO2和0.5molO2反应生成1molSO3(g)时可释放出 b kJ 的热量,而不是过量的氧气,故B错误;
C、已知硫氧键(S=O)的键能为d kJ/mol,氧氧键(O=O)的键能为e kJ/mol,则设S8分子中硫硫键键能为xKJ/mol,由S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol及反应热=反应物的键能总和-生成物的键能总和可知,8x+8e-16d=-8a,解得x=2d-a-e,所以S8分子中S-S的键能为(2d-a-e) kJ•mol-1,故C正确;
D、反应释放热量的多少与外界条件无关,只与始态和终态有关,所以使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量于于b kJ,故D错误;
故选C.
点评 本题以含硫物质考查热化学反应及计算,为高频考点,把握图象及燃烧热的概念、反应热与键能的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
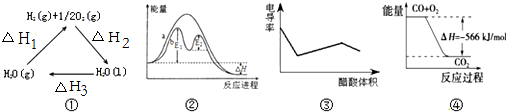
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.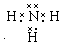 (或
(或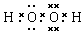 ,
,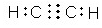 ).
). NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+ | |
| D. | 由水电离出的c(OH-)=1×10-10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com