
【题目】有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E ②C+NaOH→蓝色沉淀D+F
③D![]() A+E ④F+Ba(NO3)2→白色沉淀+NaNO3
A+E ④F+Ba(NO3)2→白色沉淀+NaNO3
回答下列问题:
(1)写出它们的化学式:
A____________ B____________ C____________
D____________ E____________ F____________
(2)写出①④反应的离子方程式:
①__________________。④_________________。
【答案】(1)CuO;H2SO4;CuSO4;Cu(OH)2;H2O;Na2SO4
(2)①CuO+2H+=Cu2++H2O
④Ba2++SO42-=BaSO4↓
【解析】
试题(1)反应②中的蓝色沉淀D为Cu(OH)2;C中含有Cu2+;F中含有Na+;反应③中A为CuO;E为H2O;反应④中白色沉淀可能为BaSO4、也可能为BaCO3;若为BaCO3,则F为Na2CO3,C为CuCO3,但CuCO3不与NaOH反应,故白色沉淀只能为BaSO4,则F为Na2SO4、C为CuSO4,B为H2SO4,E为H2O。
(2)离子方程式的书写需注意金属氧化物是不能拆的。同时,写完应注意检查。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下图所示的实验,不能达到实验目的的是(各选项中对比溶液的浓度体积均相同)( )
实验方案 |
|
|
|
|
目的 | A.验证升高温度可加快H2O2分解 | B.验证增大反应物浓度对平衡的影响 | C.比较Cu2+、Fe3+对H2O2分解速率的影响 | D.比较弱酸的相对强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);氮原子的杂化轨道类型为____。
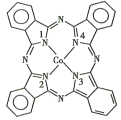
(3)Fe(CO)x,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_____(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是____________。
(5)NiAs的晶胞结构如图所示:
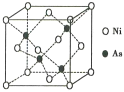
①镍离子的配位数为__________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为______cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向Al2O3和过量C粉的混合物中通入氯气,可制得易水解的AlCl3,实验装置如图所示。下列说法不正确的是

A. c中盛装的是浓硫酸
B. 实验时应先点燃d处酒精灯,再点燃a处酒精灯
C. 此反应中的尾气,除氯气外都可直接排放到大气中
D. 该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯的说法不正确的是( )
A.氯气是由瑞典化学家舍勒首先制得B.氯气是由英国化学家戴维命名的
C.氯元素主要以单质的形式大量存在海水里D.氯气是一种重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为________。
(2)在生成物中,A的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com