
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
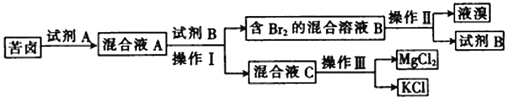
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:

已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
【答案】Cl2 bdb除去Ba2+杂质0.03加入最后一滴标准液,溶液由无色变为红色,且30 s不褪色93.45%
【解析】
Ⅰ、海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物,加入试剂A为氧化剂,发生反应生成溴单质,加入萃取剂四氯化碳萃取分液得到含溴单质的混合溶液B和混合溶液C,混合溶液B通过蒸馏得到液溴和试剂B为四氯化碳,混合溶液C通过结晶法分离氯化镁和氯化钾。
(1)若试剂A是一种有色气体单质,则A是Cl2 ,氯气氧化溴离子生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故答案为:Cl2;
(2)操作II”是从萃取剂中分离出溴单质,利用物质沸点不同,控制温度通过蒸馏方法分离得到溴单质,操作III是浓缩结晶的方法分离混合物,可以利用重结晶方法分离氯化镁和氯化钠,故答案为:b;d;
(3)试剂B是萃取剂,萃取剂与水不互溶,且溴不易溶于水,易溶于萃取剂,且不发生反应,acd水溶液中不能分层不能做萃取剂,四氯化碳不溶于水,溴单质再四氯化碳中溶解度大于水中可以做萃取剂,故选b,故答案为:b;
Ⅱ、(1)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=![]() mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=![]() mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
(2)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=![]() ×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:
×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:![]() ×100%=93.45%,故答案为:93.45%。
×100%=93.45%,故答案为:93.45%。


科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。
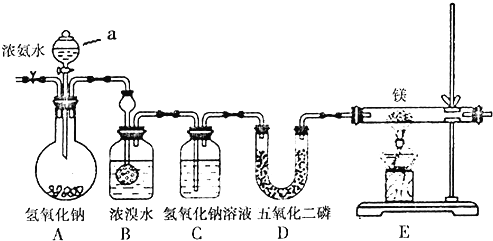
已知:氮化镁易跟水发生反应;装置B中发生的主要反应为:3Br2+2NH3=6HBr+N2、HBr+NH3=NH4Br。
实验步骤及现象:
①连接仪器并检查装置的气密性。
②通入惰性气体。
③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④点燃酒精灯,观察E中固体变成了黄绿色。
回答下列问题:
(1)A装置中仪器a的名称为______,通入惰性气体的目的是__________________。
(2)装置C的作用是______________________。
(3)D装置中的P2O5是一种非氧化性的酸性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______。
a.NH3 b. HI c. SO2 d. CO2
(4)E装置中发生反应的化学方程式为:___________________________。
(5)此装置中存在着明显缺陷,你的改进措施是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A. 3:1 B. 2:1 C. 1:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A制备一种医药合成中间体G和可降解环保塑料PHB的合成路线如下:
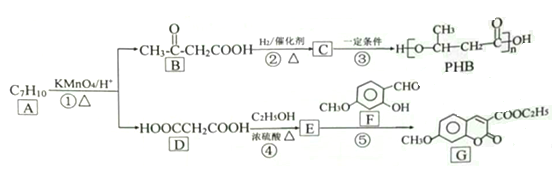
己知: ![]() (-R1、-R2、-R3均为烃基)
(-R1、-R2、-R3均为烃基)
回答下列问题:
(1)A的结构简式___________,G中含氧官能团的名称____________________。
(2)反应①和③的反应类型分别是_____________、________________。
(3)C存在多种同分异构体,其中分别与足量的NaHCO3溶液和Na反应产生气体的物质的量相同的同分异构体的数目为______种。
(4)写出反应③的化学方程式__________________________________
(5)写出满足下列条件的B的同分异构体_________________________
①能发生银镜反应 ②分子中烃基上的氢原子被取代后的一氯代物只有一种
(6)写出用B为起始原料制备高分子化合物![]() 的合成路线(其
的合成路线(其
他试剂任选)。____________________________________________
(7)上述合成路线中最后一步反应的化学方程式为:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Fe3+、K+、Cl-、MnO4- B. Ag+、Na+、NO3-、AlO2-
C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质铝应用极为广泛,从铝土矿中提取铝主要分以下三个阶段,根据要求回答相关问题
(1)铝土矿的提纯:铝土矿主要成分是Al2O3(含有Fe2O3、SiO2等杂质),提纯流程如下图所示:
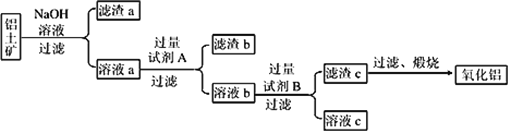
①在用NaOH溶液母液浸提过程中需研碎、湿磨,其目的是______________________________。
②向溶液a中通入过量CO2,所得不溶物煅烧后也可得Al2O3,该方法的缺点是___________________________________________________。
(2)制备无水氯化铝
其反应为:2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
③为促进该反应的进行,实际生产中需加入焦炭,其原理是_____________________________。
(3)电解制取铝
目前可低温电解AlCl3熔盐得到金属铝纯的无水氯化铝熔点190℃,沸点180℃,其导电性如图:
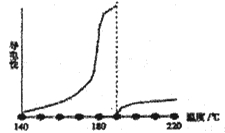
①从图中可知,AlCl3熔融液导电能力___________________________。
②但若在AlCl3中加入NaCl,使形成共融物,将AlCl3制成离子型液体,导电能力增强,熔融液中存在的阴离子是Cl-、AlCl4-、Al2Cl7-,请写AlCl3加入NaCl后形成离子型液体的两个离子方程式:AlCl3+ Cl-=AlCl4-、及平衡________________________________。
③电解时,阳极主要是AlCl4-放电,其电极反应为__________________________________。
④为保证电解进行,熔融液主要离子是AlCl4-、Al2Cl7-,则n(AlCl3)∶n(NaCl)应大于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
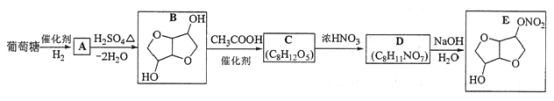
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com