
分析 (1)稀硫酸与碳酸钠反应生成气体,而氯化钠不能;
(2)稀硫酸与氯化钡反应生成沉淀,而氯化钠不能;
(3)稀硫酸和氯化钠溶液分别为酸性、中性,指示剂可鉴别.
解答 解:(1)向A、B两溶液中分别加入Na2CO3溶液,观察到A溶液中产生无色气体.则A是稀硫酸,发生的反应为H2SO4+Na2CO3=CO2↑+Na2SO4+H2O,
故答案为:稀硫酸;H2SO4+Na2CO3=CO2↑+Na2SO4+H2O;
(2)向A、B两溶液中分别加入BaCl2溶液,A溶液中的现象是产生白色沉淀,
故答案为:产生白色沉淀;
(3)石蕊遇酸为红色,遇NaCl溶液不变色,则①可鉴别,与②③④中物质均不反应,故答案为:①.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
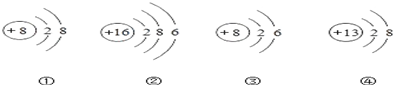
| A. | ④表示的是阳离子 | |
| B. | ?①③属于同种元素,?②④属于另一种元素 | |
| C. | ?②④形成的化合物是Al2O3 | |
| D. | ①③的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数与反应物或生成物的浓度变化无关,温度越高,平衡常数越大 | |
| B. | 25℃时,Mg(OH)2固体在同体积、同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者较小 | |
| C. | 25℃时NH4Cl溶液中的Kw大于100℃时NaCl溶液中的Kw | |
| D. | 2S℃时,H2SO3溶液的一级电离常数为Ka,则NaHSO3溶液的水解常数Kb=$\frac{Kw}{Ka}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
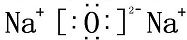 ;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).
;水溶液PH=8,则C(HY-)+2C(H2Y)=10-6-10-8mol/L(填精确值).查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取5.80 mL 乙醇溶液 | |
| B. | 乙酸的酯化反应实验中用NaOH溶液除去生成物中的乙酸 | |
| C. | 用溴水可以除去乙烷中的乙烯 | |
| D. | 食盐可以鉴别白酒和食醋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com