
下列各组中的离子,能在溶液中大量共存的是
A.H+、Na+、CO32- B.Cl-、Ba2+、SO42-
C.H+、OH-、SO42- D.H+、Ag+、NO3-
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:填空题
用编号填空:
(1)下列关于燃烧热的说法正确的是
A.101kPa时1mol氢气完全燃烧生成水蒸气所放出的热量即氢气的燃烧热;
B.101kPa时1mol碳在氧气中燃烧生成CO所放出的热量即碳的燃烧热;
C.某物质的燃烧热不随热化学方程式计量数的改变而改变。
(2)下列关于用稀盐酸和氢氧化钠稀溶液测中和热的说法错误的是
A.实验结果随反应物用量改变而改变;
B.实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和;
C.实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒。
(3)下列关于化学平衡的说法错误的是
A.若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动;
B.达到化学平衡时,各组分的浓度不再改变,反应停止;
C.化学平衡移动,化学平衡常数不一定改变。
(4)改变下列条件,化学平衡一定向正反应方向移动的是
A.增大反应物浓度 B.升高温度 C.增大压强
(5)下列关于电解质的说法错误的是
A.酸、碱、盐及氧化物都是电解质;
B.电解质溶液能导电是因为发生了电离,产生了自由移动的离子;
C.电解质不一定能导电,能导电的物质不一定是电解质。
(6)下列反应的△H<0的是
A.铝和稀硫酸反应 B.碳酸氢铵受热分解 C.氢氧化钡晶体与氯化铵晶体反应
(7)下列情况,均为日常生活中为了改变反应速率而采取的措施,其中不属于浓度影响反应速率的是
A.汽车加大油门 B.食物放冰箱 C.糕点包装袋里放小包除氧剂
(8)下列实验现象与实际不符的是
A.向4mL0.01mol/LKMnO4酸性溶液中加入2mL0.1mol/LH2C2O4溶液:溶液褪色;
B.浓度均为0.1mol/L的Na2S2O3和H2SO4溶液等体积混合:溶液变浑浊;
C.将盛有NO2和N2O4混合气体的容器压缩:混合气体颜色比压缩前浅。
(9)一定温度下,有三种酸:A.盐酸,B.硫酸,C.醋酸,回答下列问题:
①三种酸溶液等物质的量浓度时,c(H+)最大的是 ;
②三种酸的c(H+)相同时,溶液浓度最大的是 ;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,再加入同样的锌粒,反应最快的是 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省资阳市高三上学期第一次诊断性测试理综化学试卷(解析版) 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
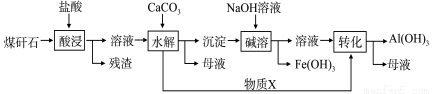
(1)“酸浸”过程中主要反应的离子方程式为:_____________、_____________。
(2)“酸浸”时,提高浸出速率的具体措施有_____________、_____________。(写出两个)
(3)“碱溶”的目的是_____________。物质X的化学式为_____________。
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:_____________。
(5)若根据过滤出的Fe(OH)3沉淀来推算煤矸石中Fe2O3 的含量,须将沉淀清洗干净,检验沉淀是否洗干净的具体操作方法是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省贵阳市新天学校高一上学期期中测试化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Na+ Mg2+ Cl_ OH_
B.H+ Ca2+ CO3_ NO3_
C.Cu2+ K+ SO42_ NO3_
D.Na+ HCO3_ OH_ Ca2+
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三11月月考理科综合化学试卷(解析版) 题型:填空题
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高一上学期期中考试化学试卷(解析版) 题型:选择题
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A.用CCl4提取溴水中的Br2 | B.从KI和I2的固体混合物中回收I2 | C.稀释浓硫酸 | D.工业酒精制备无水酒精 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列有关海水综合利用的说法正确的是( )
A.电解饱和食盐水可制得金属钠 B.海水提溴涉及到氧化还原反应
C.海带提碘只涉及物理变化 D.海水提镁不涉及复分解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:填空题
(1)化学键的键能是指气态原子间形成1 mol化学键时释放的能量。下表列出了某些化学键的键能:

化学键 | H—H | O==O | O—H |
键能(kJ·mol-1) | 436 | x | 463 |
请回答下列问题:
①如图表示某反应的能量变化关系图,此反应为 (填 “放热”或“吸热”)反应,其中ΔH= kJ·mol-1(用含C和D的字母表示)。
②若此能量变化关系图表示反应H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则B= kJ·mol-1,x=
(2)①火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)=N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)=H2O(l)+ O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)=H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___________________。
②肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com