
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】某课外小组利用下图装置制取乙酸乙酯,其中A盛浓硫酸,B盛乙醇、无水醋酸,D盛饱和碳酸钠溶液。
已知:
①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②几种有机物沸点:乙醚34.7℃,乙醇78.5℃,乙酸117.9℃,乙酸乙酯77.1℃;
③乙酸与乙醇反应生成酯的过程中酸分子断裂C-O键,醇分子断裂O—H键。

请回答:
(1)乙醇分子中官能团的名称是__________________。
(2)A的名称是_____________;浓硫酸的主要作用是作____________________。
(3)在B中加入几块碎瓷片的目的是_______;C除起冷凝作用外,另一重要作用是_____。
(4)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制乙酸乙酯的化学方程式__________;该反应类型为___________。
(5)D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,其净化过程如下:
ⅰ:加入无水氯化钙,去除_________________;
ⅱ:最好加入________(填字母序号)作吸水剂;
A 碱石灰 B 氢氧化钾 C 无水硫酸钠
ⅲ:蒸馏,收集77℃左右的馏分,得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学规范保存试剂以防变质,下列试剂在实验室中的保存方法错误的是( )
A.少量金属钠保存在盛有煤油的广口瓶中
B.浓硫酸盛放在使用橡胶塞密封的广口瓶中
C.浓硝酸密封盛放在棕色细口玻璃瓶中,置于阴凉处
D.保存FeSO4溶液加入少量铁粉并密封
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示回答问题:
(1)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是______(填字母)。
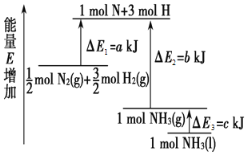
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)===NH3(l)ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)===NH3(g)ΔH=(a+b)kJ·mol-1
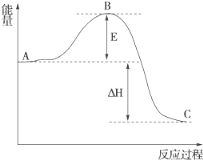
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为__________________________。
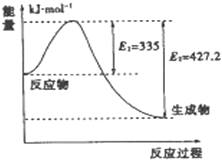
(3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?___________________________________。
②图中ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2),黄绿色易溶于水的气体,是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为_____.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
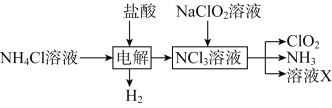
①电解时发生反应的化学方程式为_______________________________。
②除去ClO2中的NH3可选用的试剂是________(填标号)。
a.水 b.碱石灰
c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
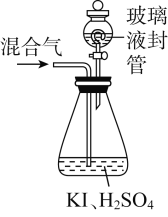
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-===2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为________________。
②测得混合气中ClO2的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
I.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下图所示,试回答下列问题:
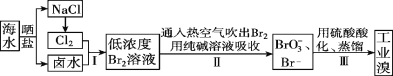
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是________。
(2)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________。
A 氧化性 B 还原性 C 挥发性 D腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
___Br2+___=___+___Br-+___CO2↑ ________。
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:________。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_________。
Ⅱ.目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
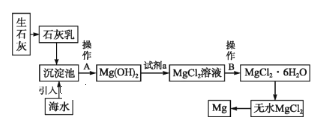
(6)操作A是_________,试剂a是__________。
(7)由无水MgCl2制取Mg的化学方程式是_________。从考虑成本和废物循环利用的角度,副产物可以用于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:

已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cu + 8HNO3(稀) ==3Cu(NO3)2 + 2NO↑+ 4H2O的反应中,氧化剂与还原剂的物质的量之比是
A. 1:1 B. 3:8 C. 2:3 D. 8:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com