
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )
A.0.15mol/LB.0.20 mol/LC.0.35 mol/LD.0.40 mol/L
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】写出与下列事实相符的金属钠的主要物理性质:
(1)用小刀切割金属钠,表现其______________________
(2)金属钠能浮在水面上,表现其______________________
(3)金属钠微微受热时会熔化成一个闪亮的小球,表现其___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
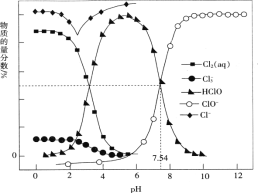
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,a mL三种气态烃的混合物与b mL过量的氧气引燃爆炸后,恢复到原来的状态,气体的体积比反应前缩小2amL,则三种气态烃不可能是( )
A. CH4、C2H4、C3H4B. C2H6、C3H6、C4H6
C. C2H4、C2H2、C3H8D. C2H2、CH4、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
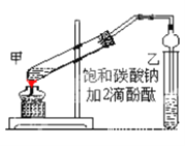
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:________________________;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________________________。
(2)甲试管中,混合溶液的加入顺序:________________________;
(3)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(4)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇
B. 反应掉乙酸并吸收乙醇
C. 乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D. 加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有____________(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸。
(7)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2mL乙醇、1mL乙酸、3mL 18mol·L1浓硫酸 | 饱和Na2CO3溶液 | 3. 0 |
B | 2mL乙醇、1mL乙酸、3mL H2O | 0. 1 | |
C | 2mL乙醇、1mL乙酸、3mL 2mol·L1 H2SO4 | 0. 6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0. 6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和________mol·L1。
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(8)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为。___________(产率%=(实际产量/理论产量)×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、K+、HCO3-、SO32-等离子。向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是( )
A.Na+B.SO32-C.K+D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)硫离子的结构示意图_____________。
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象____________。二氧化硫呈现______________(选填“氧化性”、“还原性”)。
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
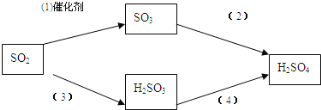
请分别写出(1)和(4)的化学方程式: ________________, ___________________。
(5)你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④ C. ①③⑤ D. ①③④⑤
(6)硫酸盐的种类很多,且应用广泛,医疗上常用_______(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用_________(写化学式)作净水剂。
(7)有化学反应2SO2(g)+O2(g)![]() 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com