
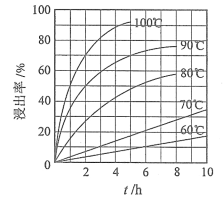
����Ŀ��[2017�¿α���]Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ���������������Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2�����ʣ����Ʊ��������������£�
�ش��������⣺
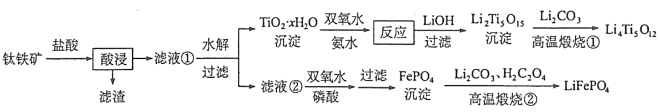
��1���������ʵ���У����Ľ����ʽ������ͼ��ʾ����ͼ��֪�������Ľ�����Ϊ70%ʱ�������õ�ʵ������Ϊ___________________��
��2���������������Ҫ��![]() ��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ__________________��
��3��TiO2��xH2O������˫��ˮ����ˮ��Ӧ40 min����ʵ�������±���ʾ��
�¶�/�� | 30 | 35 | 40 | 45 | 50 |
TiO2��xH2Oת����% | 92 | 95 | 97 | 93 | 88 |
����40 ��ʱTiO2��xH2Oת������ߵ�ԭ��__________________��
��4��Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
��5��������Һ������![]() ������˫��ˮ�����ᣨ����Һ�������1������ʹ
������˫��ˮ�����ᣨ����Һ�������1������ʹ![]() ǡ�ó�����ȫ����Һ��
ǡ�ó�����ȫ����Һ��![]() ����ʱ�Ƿ���Mg3(PO4)2�������ɣ� ����ʽ���㣩��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ
����ʱ�Ƿ���Mg3(PO4)2�������ɣ� ����ʽ���㣩��FePO4��Mg3(PO4)2��Ksp�ֱ�Ϊ![]() ��
��
��6��д��������������������FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ ��
���𰸡���1��100����2h��90����5h
��2��FeTiO3+ 4H++4Cl = Fe2++ ![]() + 2H2O
+ 2H2O
��3������40����TiO2��xH2Oת����Ӧ�������¶����߶����ӣ�����40����˫��ˮ�ֽ��백���ݳ�����TiO2��xH2Oת����Ӧ�����½�
��4��4
��5��Fe3+ǡ�ó�����ȫʱ��c(![]() )=
)=![]() mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(
mol��L1=1.3��10�C17 mol��L1��c3(Mg2+)��c2(![]() )��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
)��(0.01)3��(1.3��10�C17)2=1.7��10�C40��Ksp [Mg3(PO4)2]����˲�������Mg3(PO4)2������
��6��2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O��+ 3CO2��
2LiFePO4+ H2O��+ 3CO2��
����������1����ͼʾ��֪���������ʱ���ľ�����Ϊ70%ʱ����Ӧѡ����100����2h��90����5h�½��У�
��2���������ʱ�������ܽ�FeTiO3����![]() ʱ��������Ӧ�����ӷ���ʽΪFeTiO3+4H++4Cl��Fe2++
ʱ��������Ӧ�����ӷ���ʽΪFeTiO3+4H++4Cl��Fe2++ ![]() + 2H2O��
+ 2H2O��
��3���¶���Ӱ�����ʵ���Ҫ���أ���H2O2�ڸ������ֽ⡢��ˮ�ӷ�����ԭ���ǵ���40����TiO2��xH2Oת����Ӧ�������¶����߶����ӣ�����40����˫��ˮ�ֽ��백���ݳ�����TiO2��xH2Oת����Ӧ�����½���
��4��Li2Ti5O15��LiΪ+1�ۣ�OΪ�C2�ۣ�TiΪ+4�ۣ�������(![]() )����Ԫ���ԨC1�ۣ������������ĿΪx�������������ϼ۴�����Ϊ0����֪(+1)��2+(+4)��5+(�C2)��(15�C2x)+(�C1)��2x=0����ã�x=4��
)����Ԫ���ԨC1�ۣ������������ĿΪx�������������ϼ۴�����Ϊ0����֪(+1)��2+(+4)��5+(�C2)��(15�C2x)+(�C1)��2x=0����ã�x=4��
��5��Ksp[FePO4]=c(Fe3+)��c(![]() )=1.3��10�C2����c(
)=1.3��10�C2����c(![]() )��
)��![]() ��1.3��10�C17 mol/L��Qc[Mg3(PO4)2]��c3(Mg2+)��c2(
��1.3��10�C17 mol/L��Qc[Mg3(PO4)2]��c3(Mg2+)��c2(![]() )��(0.01)3��(1.3��10�C17)2=1.69��10�C40��1.0��10�C24����������
)��(0.01)3��(1.3��10�C17)2=1.69��10�C40��1.0��10�C24����������
��6��������FePO4��Li2CO3��H2C2O4��ϼ��ȿɵ�LiFePO4�����ݵ����غ��ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O��+ 3CO2����
2LiFePO4+ H2O��+ 3CO2����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���ձ� ������ ����ƿ �������� ���Թ� ����ƿ ��������
A. �ڢܢ� B. �٢ޢ� C. �ۢܢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
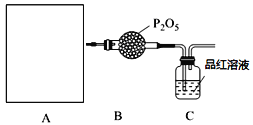
����Ŀ��Ϊ��֤������Cl2>Fe3+> SO2��ijС������ͼ��ʾװ�ý���ʵ�飨�г�������A�м���װ�����ԣ��������Ѽ��飩��
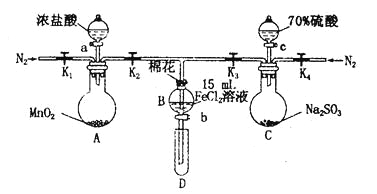
ʵ����̣�
I�����ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��������a���μ�һ������Ũ���ᣬ��A���ȡ�
������B����Һ���ʱ��ֹͣ���ȣ��ر�K2��
��������b��ʹԼ2 mL����Һ����D�Թ��У��������е����ӡ�
V����K3�ͻ���c������70%�����ᣬһ��ʱ���ر�K3��
���������Թ�D���ظ�������������B��Һ�е����ӡ�
��1������I��Ŀ����____��
��2������B����Һ�Ƿ���Fe2+�ķ���֮һ�ǣ�ȡ����B����Һ���Թ��У��μӼ��κ���+3����Ԫ�ص��������Һ���������ɫ������д���÷�Ӧ�����ӷ���ʽ____ ��
��3�������III��B�еĻ�ɫ��Һ��ͨ��H2S���壬��۲쵽�е���ɫ�������ɣ�д���÷�Ӧ�����ӷ���ʽ____��
��4��������ȡ��SO2ͨ�������ữ�ĸ��������Һ��ʹ��Һ��ɫ���䷴Ӧ�Ļ�ѧ����ʽΪ________��
��5���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬�������±���ʾ�����ǵļ����һ�����ܹ�֤��������Cl2>Fe3+>SO2����____������������������������������
��������B��Һ�к��е����� | ��������B��Һ�� ���е����� | |
�� | ��Fe3+��Fe2+ | ��SO42- |
�� | ����Fe3+����Fe2+ | ��SO42- |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
��6����B�е�FeCl2��Һ����100 mLFeBr2��Һ��������ͨ��1��12 LCl2����״���£�������Һ����1/2��Brһ�������ɵ���Br2����ԭFeBr2��Һ��FeBr2�����ʵ���Ũ��Ϊ____ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֲ���ͳ���Ҫ��ȡ���зḻ����֬�����з�����ƺ�������(����)
A.������ˮ���ݣ�ʹ���е���֬����ˮ��Ȼ���ٷ���
B.�Ƚ���ѹ�ɿ���״�����������л��ܼ����ݣ�Ȼ��Խ���Һ�����������
C.�����ü���Һ������ʹ���е���֬�ܽ⣬Ȼ������������
D.�����飬Ȼ������������ȣ�ʹ���е���֬�ӷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(NH4)2Fe(SO4)2��6H2O�׳�Ī���Σ�dz��ɫ���壬�ǻ�ѧ���������еij����Լ�����ֽ�������ӣ�ij������ͨ��ʵ�����Ī���θ�����������ʱ�ķֽ���
�ŷֽ�װ��AӦѡ��_________(��١��ڡ�)��
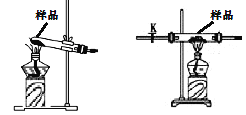
�� ��
����ʵ����Aװ���еĹ����Ϊ����ɫ�����������к���_____��Cװ���к�ɫ��ȥ��˵����������к���______��Cװ�ú�Ӧ��װ��D��δ����������������_______��
��������������װ��֤���ֽ�����к��а�����ֻ�����B��C�е��Լ����ɣ����������Լ�ΪB_____________��C______________������ţ���
�ټ�ʯ�� ����ˮ�Ȼ��� �۷�̪��Һ ��ϡ����
��ijͬѧ��ΪĪ���ηֽ���ܻ�����N2��SO3���������װ����ѡ����ʵ�װ�ü���֤��������ȷ������˳����A��_____��_____��E����Ӧһ��ʱ����ٽ�_______��
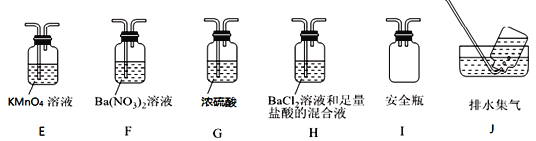
����ʵ��֤ʵ��2����3���IJ�������ȷ�ģ���4���е��������ֻ��һ�֣�����ֻ��ˮ���ɣ���ݴ��Ʋ��Ī���ηֽⷴӦ�Ļ�ѧ����ʽ����Ϊ ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӏ�������ֵ������˵������ȷ���ǣ� ��
A. 9.2g NO2��N2O4�Ļ�����к���ԭ����ĿΪ0.2NA
B. ���³�ѹ�£�35.5g Cl2��������NaOH��Һ��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.5NA
C. ��״���£�2.24LNH3��1.6gCH4����������������Ŀ��ΪNA
D. ��֪��ӦN2(g)+3H2(g)![]() 2NH3(g)��H=-92.4kJ mol-1��������NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
2NH3(g)��H=-92.4kJ mol-1��������NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ͷ�뵽�Ȼ�����Һ�У�������
A. Fe(OH)3��NaCl,H2
B. Fe,NaCl
C. NaOH��H2
D. H2��NaCl��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�����ܱ������г���X(g)��Y(g)��������ӦX(g)+Y(g)![]() M(g)+N(g)������ʵ���������±���
M(g)+N(g)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.10 | 0.10 | 0.09 |
�� | 800 | 0.20 | 0.20 | 0.10 |
�� | 800 | 0.20 | 0. 30 | a |
�� | 900 | 0.10 | 0.15 | b |
����˵���������
A. ʵ����У���5minʱ���n(M) =0.05mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N) =0.01 mol/( L��min)
B. ʵ����У��÷�Ӧ��ƽ�ⳣ��K= 1.0
C. ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ����У��ﵽƽ��ʱ��b>0.06
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com