
| 物质 | 熔点/℃ | 沸点/℃ |
| N2O5 | 41 | 32 (升华) |
| N2O4 | -11 | 24 |
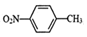 ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题: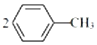 +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
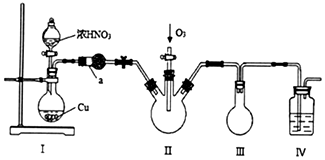
+H2O.分析 I由浓硝酸和铜制备NO2,干燥后于II中与O3反应制得N2O5,III为安全瓶,IV为处理尾气,
(1)铜和浓硝酸反应生成硝酸铜和NO2,NO2气体为红棕色;
(2)根据仪器构造和作用分析可知;
(3)N2O5与水生成液态的硝酸;
(4)装置III为安全瓶;
(5)甲苯与N2O5反应生成对硝基甲苯和水,设N2O5生成对硝基甲苯的转化率为x,则生成的对硝基甲苯为30×10-3L×1mol/L×x×137g/mol=1.73,据此计算.
解答 解:(1)铜和浓硝酸反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;NO2气体为红棕色,故装置Ⅰ中烧瓶上部可观察到有红棕色气体生成;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;有红棕色气体生成;
(2)仪器为球形干燥管,作用是干燥生成的NO2,故应盛放固态的酸性或中性干燥剂,五氧化二磷可选;
故答案为:球形干燥管;D;
(3)干燥不完全,导致有硝酸生成,收集到的N2O5固体中含有液态物质;
故答案为:干燥不完全,导致有硝酸生成;
(4)装置III为安全瓶,防止倒吸;
故答案为:安全瓶,防止倒吸;
(5)①甲苯与N2O5反应生成对硝基甲苯和水,反应为: +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O;
+H2O;
故答案为: +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O;
+H2O;
②设N2O5生成对硝基甲苯的转化率为x,则生成的对硝基甲苯为30×10-3L×1mol/L×x×137g/mol=1.73,解得x=21.05%;
故答案为:21.05%.
点评 本题考查了物质制备方案设计,主要考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该变化说明原子核在化学反应中也能发生变化 | |
| B. | 该变化遵循质量守恒定律 | |
| C. | 1n是一种电中性粒子 | |
| D. | 对于30P:原子序数=质子数=中子数=核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
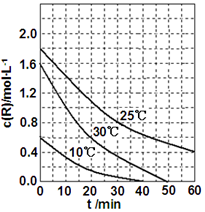 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
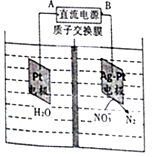
| A. | A极为负极,电子从铂电极流向该极 | |
| B. | Pt电极上发生还原反应 | |
| C. | Ag-Pt电极发生的反应是:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 电解一段时间后,两地减少的质量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在需要在加热条件下才能发生 | |
| D. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
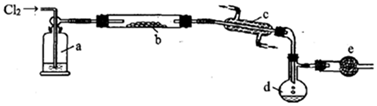
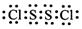 ;装置a中的试剂是浓硫酸.
;装置a中的试剂是浓硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
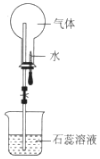
| A. | 烧瓶中的溶液呈红色,则原气体一定是SO2 | |
| B. | 烧瓶中的溶液呈蓝色,则原气体可能是NH3 | |
| C. | 形成喷泉的原因是烧瓶内压强大于外界大气压 | |
| D. | 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com