
【题目】下列反应中,属于取代反应的是( )
A.甲烷在空气中燃烧B.用光照射甲烷和氯气的混合气体
C.乙烯制备聚乙烯D.乙烯通入到溴的四氯化碳溶液,溶液褪色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
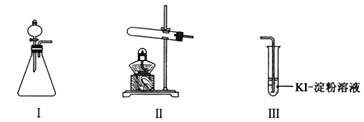
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.氢硫酸 D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)_____________________造成的,请设计实验证明他们的猜想是否正确。_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:
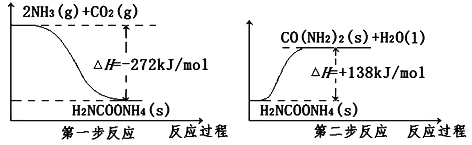
①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是
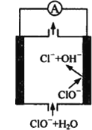
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温迫使植物细胞产生大量对细胞有害的过氧化物,如脂质过氧化物(MDA)。超氧化物歧化酶(SOD)能够消除过氧化物,从而增强植物的抗冷性。研究人员进行了“水杨酸对水稻幼苗抗冷性的影响”实验,实验步骤及结果如表所示。
组别 | 处理 | 培养温度 /℃ |
|
1 | 蒸馏水浇灌 | 25 | 7.3 |
2 | ① | ② | 9.4 |
3 | 0.5 mmol/L水杨酸浇灌 | 5 | 10.3 |
4 | 1.0 mmol/L水杨酸浇灌 | 5 | 11.6 |
5 | 1.5 mmol/L水杨酸浇灌 | 5 | 13.6 |
6 | 2.0 mmol/L水杨酸浇灌 | 5 | 8.5 |
7 | 2.5 mmol/L水杨酸浇灌 | 5 | 7.9 |
8 | 3.0 mmol/L水杨酸浇灌 | 5 | 6.5 |
(1)表中①是 ,②是 ,其的作用为 ,实验设计时每组取50株水稻幼苗,而不是1株,目的是 。
(2)本实验自变量为 , ,需要控制的无关变量有 , (至少写两个)。
(3)组别1和2对照可得的结论是 。对比组别2~8可得的结论是 。
(4)在5 ℃的环境下,物质的量浓度为2.0 mmol/L的水杨酸对水稻幼苗抗冷性的影响是 (填“增强”或“减弱”)。
(5)请根据5 ℃条件下的实验结果完成水杨酸浓度—SOD活性关系的坐标曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
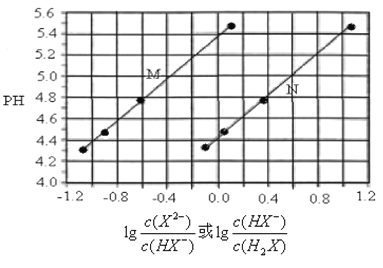
A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。Ga的外围电子排布式为:_____________________,基态Ga原子核外有______种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为_________,中心原子的杂化类型为________;砷酸的酸性弱于硒酸,从分子结构的角度解释原因_______________________。
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如下图A)。

①该配合物中中心原子的化合价为________;与中心原子形成配位键的原子是________。
②与ClO4-互为等电子体的一种非极性分子是_______(举1例)。
③1 mol Bipy中所含σ键______mol。
(4)钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为__________。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com