
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示。下列关于普伐他汀的性质描述正确的是( )
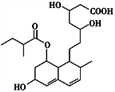
①能与FeCl3溶液发生显色反应 ②能使酸性KMnO4溶液褪色 ③能发生加成、取代、消去反应 ④1 mol该物质最多可与1 mol NaOH反应
A. ①② B. ②③ C. ①④ D. ②④
科目:高中化学 来源: 题型:
【题目】取一小粒金属钠放在燃烧匙里加热,实验现象有下列描述:
①金属钠先熔化②在空气中燃烧,产生紫色火焰③燃烧后生成白色固体④燃烧时火焰呈黄色⑤燃烧后生成淡黄色固体物质,其中描述正确的是
A. ①② B. ①②③ C. ①④⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 物质发生化学反应时不一定都伴随着能量变化
B. 伴有能量变化的变化都是化学变化
C. 放热反应不需要加热就一定能发生
D. 反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )min,原因是 .
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 . (设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列以减慢反应速率.(填写代号)
A.蒸馏水
B.冰块
C.HNO3溶液
D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图. 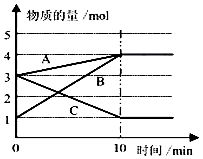
①该反应的化学方程式是 .
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率= ![]() ×100%】,请写出计算过程,计算结果保留1位小数)
×100%】,请写出计算过程,计算结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是高中化学重点学习大三大气体之一,是常见的大气污染物之一,同时有是重要的工业原料,探究其制备方法和性质具有非常重要的意义,请回答下列问题。
Ⅰ.某研究小组将纯净的SO2气体通入0.5mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设一
①请在下表空白处填写相关实验现象。
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ | 假设一成立 |
实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ____ |
②设计实验1的目的是_________。
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图甲所示。实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
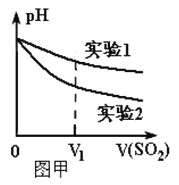
Ⅱ.我国规定空气中SO2含量不得超过0.02mg/L。某化学兴趣小组选用图乙实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

(1)若原料气从左向右流时,上述装置连接的顺序是:原料气→______ (用字母和箭头表示)。当装置②中出现_______现象时,立即停止通气。
(2)你认为下列试剂中,可以用来代替试管中的酸性KMnO4溶液的是________。(填字母代号)
A.NaOH溶液 B.溴水 C.氨水 D.BaCl2溶液
Ⅲ.中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行定性测定。
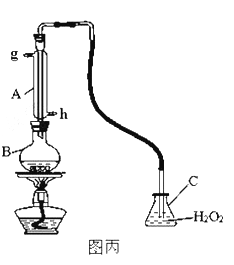
(1)B中加入250.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,除去C中过量的H2O2,然后用0.0900mol/L NaOH标准溶液进行滴定,滴定终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g/L。
(2)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( ) 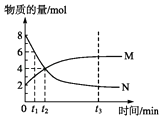
A.化学方程式:2NM
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,M的浓度是N浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝均可在冷的浓硫酸或浓_____酸中发生钝化,即在表面生成一层致密的______;“铁红”的主要化学成分是_____;Fe2(SO4)3溶液呈_____色;生铁主要是铁和__的合金。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A,B,C,D四种元素,A,B同周期,A,B可形成两种无色无味气体AB和AB2 . D在B的下一周期,其最高价氧化物的水化物是二元强酸,D,C可形成离子化合物CD,D离子比C离子多一个电子层.据此可知:
(1)这四种元素分别是A:_、B:、C:、D: .
(2)C离子的离子结构示意图是 .
(3)化合物CD的电子式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com