
科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:填空题
氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________g•cm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:选择题
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
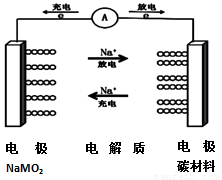
A.电池放电时,溶液中钠离子向负极移动
B.该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D.电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
下列物质变化时,不需要破坏化学键的是( )
A.HCl溶于水 B.烧碱熔化 C.H2燃烧 D.I2升华
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
关于下列图示的说法中正确的是( )
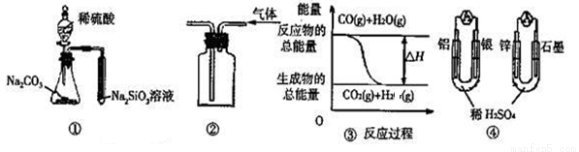
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”为吸热反应
CO2(g)+H2(g)”为吸热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
含氮化合物是化学与工业中运用广泛的物质。
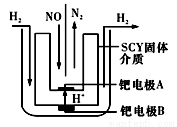
(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)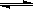 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
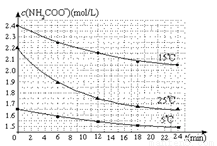
根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是( )
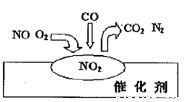
A.NO2是该过程的最终产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:计算题
在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到 平衡时碘化氢的转化率和氢气的物质的量浓度。2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.邻二甲苯苯环上的一氯取代产物有2种
B.甲苯分子中最多有12个原子在同一平面内
C.乙二醇与甘油互为同系物
D.油脂在烧碱溶液中能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com