
【题目】糖类、油脂和蛋白质的共同特点是( )
A.均是高分子化合物
B.常温下,遇碘水均会显蓝色
C.均只含有C,H,O三种元素
D.均是生命活动必不可少的物质
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是( )
A.HgCl2属于离子化合物
B.HgCl2属于共价化合物
C.HgCl2属于非电解质
D.HgCl2是弱酸弱碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系(反应条件略去),A、B、C、D中均含有同一种元素,回答下头问题:
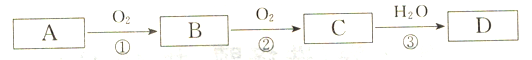
(1)若A为Na,则固体C的颜色为__________________,写出反应③的化学方程式___________________________。
(2)若A为N2,写出反应③的化学方程式___________________________。
(3)若A为S,写出D的浓溶液与Cu在加热情况下反应的化学方程式____________________。
(4)若A为NH3,则__________(填“能”与“不能”)用铁制容器储存D的浓溶液。写出过量Fe与D的稀溶液反应(还原产物只有B)的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.对该反应体系加热
B.加入少量NaCl溶液
C.不用锌片,改用锌粉
D.加入少量1 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在由水电离产生的H+浓度为1×10﹣13molL﹣1的溶液中,一定能大量共存的离子组是( )
A.K+、Cl﹣、NO ![]() 、S2﹣
、S2﹣
B.Na+、Ca2+、Cl﹣、HCO ![]()
C.K+、Ba2+、Cl﹣、NO ![]()
D.SO ![]() 、Mg2+、I﹣、S2O
、Mg2+、I﹣、S2O ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法正确的是( )
A. 该合金中铜与镁的物质的量之比是1∶2
B. 该浓硝酸中HNO3的物质的量浓度是13.0 mol/L
C. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程从海带中提取碘单质。
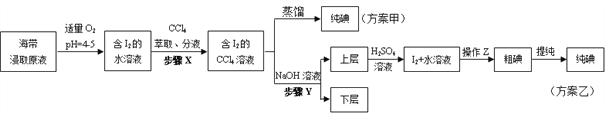
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com