
【题目】工业上常采取以下方法除去H2S和SO2以减少有害气体的排放。完成下列填空:
I.H2S的除去
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被O2氧化使Fe2(SO4)3再生,其原理为:□FeSO4+□O2+□H2SO4![]() □Fe2(SO4)3+□ 。
□Fe2(SO4)3+□ 。
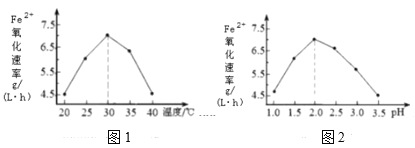
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为__;若反应温度过高,反应速率下降,其原因是__。
(2)补全、配平Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。______。
(3)在一定条件下,也可以用H2O2氧化H2S,其氧化产物随参加反应的n(H2O2)/n(H2S)变化而不同,当n(H2O2)/n(H2S)=4时,氧化产物的化学式为__。
II.SO2的除去
用NaOH溶液吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:___。
(5)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
(6)也可用氨水除去SO2。某废气含0.2%SO2和10%SO2(体积含量,其余为N2),一定条件下,该废气以5m3/h的速率通过催化剂与速率为20L/h的NH3混合,再喷水,得到(NH4)2SO4晶体(气体体积均已折算为标准状况)。通过计算说明NH3速率控制在20L/h的原因。________。
【答案】30℃、pH=2 催化剂活性下降或催化剂在30℃时活性最大 ![]() H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值符合2:1,两者完全转化为(NH4)2SO4
H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值符合2:1,两者完全转化为(NH4)2SO4
【解析】
(1)用Fe2(SO4)3吸收H2S,硫化氢具有还原性,硫酸铁具有氧化性,二者发生氧化还原反应生成单质硫,反应的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,从图象中分析可知,使用硫杆菌的最佳条件是亚铁离子氧化速率最大时,需要的温度和溶液PH分别为:30℃、pH=2.0;反应温度过高,反应速率下降是因为升温使蛋白质发生变性,催化剂失去生理活性,
故答案为:30℃、pH=2.0;催化剂活性下降或催化剂在30℃时活性最大;
(2)此反应中氧气是氧化剂,每个氧分子得4e,Fe2+被氧化为Fe3+,根据电子守恒、原子守恒可知发生反应的化学方程式为![]() ,并用单线桥分析为
,并用单线桥分析为![]() ,
,
故答案为:![]() ;
;
(3)当![]() =4时,结合氧化还原反应电子守恒,4H2O28H2O8e,电子守恒得到H2S变化为+6价化合物,H2SH2SO48e,氧化产物的分子式为H2SO4,
=4时,结合氧化还原反应电子守恒,4H2O28H2O8e,电子守恒得到H2S变化为+6价化合物,H2SH2SO48e,氧化产物的分子式为H2SO4,
故答案为:H2SO4;
(4)过程①是二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,反应的离子方程式为:2OH+SO2=SO32+H2O,
故答案为:2OH+SO2=SO32+H2O;
(5)过程②加入CaO,存在CaO(s)+H2O(l)═Ca(OH)2(s)Ca2+(aq)+2OH(aq),因SO32与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成,
故答案为:SO32与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成;
(6)废气中每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值为:v(NH3):v(SO2)=2:1时NH3与SO2完全转化为(NH4)2SO4,即需要将NH3速率控制在20L/h,
故答案为:废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速率比值符合2:1,两者完全转化为(NH4)2SO4。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有机物相关描述不正确的
A.用溴水能区分乙酸、己烯、苯、四氯化碳
B. 分子中至少有11个碳原子处于同一平面上
分子中至少有11个碳原子处于同一平面上
C.甘氨酸(H2N—CH2COOH)、丙氨酸[CH3CH(NH2)COOH]、谷氨酸[HOOC—CH2CH2CH(NH2)COOH]一定条件下形成链状三肽的结构最多有3种
D.1mol有机物 一定条件下能和6molNaOH反应。
一定条件下能和6molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人尝试用工业制纯碱原理来制备![]() 。他向饱和
。他向饱和![]() 溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到
溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。写出生成白色晶体的化学方程式:________。分析该方法得不到![]() 的原因可能是_______________。
的原因可能是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )

A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为m,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.36.5 g氯化氢含有NA个原子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数为=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-,SO42-和NO3-的相互分离,实验过程如下:
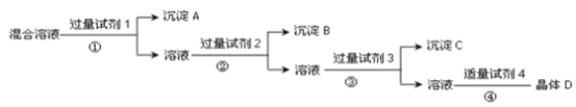
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为 ___,试剂2为___,试剂4为_________。
(2)加入过量试剂3的目的是_________ 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )

A. 分子中含有三种含氧官能团
B. 既能与FeCl3发生显色反应,也能和Na2CO3反应
C. 既可以发生取代反应,又能发生加成反应
D. 1 mol该化合物最多能与6molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
⑴若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________L,V(H2)=________L.
⑵若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )
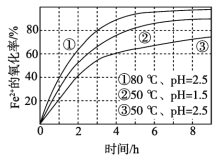
A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com