
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
| 实验序号 | 金属质量/g | 金属状态 | C(H2SO4)/mol.-L | V(H2SO4)/mL | 溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.1 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
分析 (1)①Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,原电池反应比化学反应速率快;
②所给四种溶液中只Zn只能置换出Ag;
③为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;生成的单质Cu会沉积在Zn的表面,影响了反应速率;
(2)影响反应速率的因素:温度、浓度、催化剂、接触面积等,注意控制变量法在实验中的应用.
解答 解:(1)①Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率;
②所给四种溶液中只Zn只能置换出Ag,即Ag2SO4与CuSO4溶液具有相似的作用,故答案为:Ag2SO4;
③要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:30;10;当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)①反应是放热反应,所以反应物的总能量大于产物的总能量,故答案为:>;
②实验2和5表明,其他条件一样的情况下,浓度对反应速率有影响,浓度高,速率快,故答案为:浓度;
③实验4和5表明,固体表面积对反应速率有影响,固体表面积大反应速率越快,能表明同一规律的实验还有1和2,故答案为:固体表面积;固体表面积越大;1和2;
④影响反应速率的因素:温度、浓度、催化剂、接触面积等,本实验中影响反应速率的其他因素还有温度,故答案为:温度.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(1)小题,首先V1、V6、V9的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2、H2O都是非极性分子 | |
| B. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| C. | 用价层电子对互斥理论预测H2S和BF3的立体结构,分别为V形、三角锥形 | |
| D. | 石英、食盐、金属钠、干冰的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
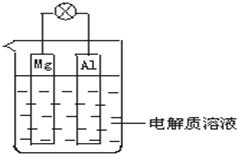 如图所示,试回答下列问题 (灯泡功率合适):
如图所示,试回答下列问题 (灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产水泥和玻璃都要用石灰石做原料 | |
| B. | 玻璃钢是一种合金材料 | |
| C. | 除去氨气中的水蒸气可用无水氯化钙可做干燥剂 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定这两种溶液的pH值 | B. | 在酸性条件下加入KI淀粉溶液 | ||
| C. | 观察二者的颜色 | D. | 用AgNO3和HNO3两种试剂来区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.2mol | C. | 0.45mol | D. | 0.65mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
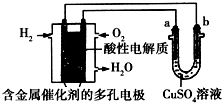
| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度不变 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com