
| 物质 | 分子的价层电子对数 | 中心原子的杂化轨道类型 | 分子的立体构型名称 |
| X2Z | V形 | ||
| YZ2 |
分析 X、Y、Z均为短周期元素,且原子序数依次增大,X原子K层的电子数只有一个,则X为H元素;Y位于X的下一周期,它的最外层电子数比K层多2个,则Y为C元素;Z原子核外的最外层电子数比次外层少2个,原子只能有3个电子层数,最外层电子数为6,故Z为S元素,故化合物X2Z和YZ2分别为:H2S和CS2.
解答 解:X、Y、Z均为短周期元素,且原子序数依次增大,X原子K层的电子数只有一个,则X为H元素;Y位于X的下一周期,它的最外层电子数比K层多2个,则Y为C元素;Z原子核外的最外层电子数比次外层少2个,原子只能有3个电子层数,最外层电子数为6,故Z为S元素,故化合物X2Z和YZ2分别为:H2S和CS2.
(1)X、Y、Z的元素符号分别为:H、C、S,故答案为:H;C;S;
(2)X2Z为H2S,分子中S原子形成2个σ键,含有2对孤对电子,价层电子对数为4,S原子采取sp3杂化,分子结构为V形,
YZ2为CS2,结构简式为S=C=S,分子中C原子形成2个σ键,没有孤对电子,价层电子对数为2,C原子采取sp杂化,分子结构为直线形,
故答案为:
| 物质 | 分子的价层电子对数 | 中心原子的杂化轨道类型 | 分子的立体构型名称 |
| X2Z | 4 | sp3 | V形 |
| YZ2 | 2 | sp | 直线形 |
点评 本题是对物质结构与性质的考查,涉及结构与位置关系、杂化方式与空间构型、等电子体等,掌握利用价层电子对互斥理论与杂化轨道判断空间构型,注意同周期主族元素中第一电离能异常情况.


科目:高中化学 来源: 题型:推断题
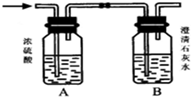 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:| ① | ② | ③ | ④ | ⑤ |
| . | . |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
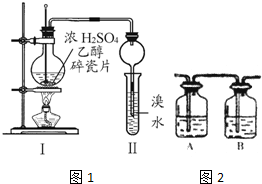 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
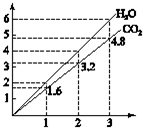 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )| A. | ②⑤⑥ | B. | ④⑥ | C. | ①②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
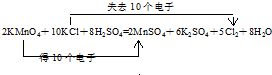 .
.
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃在适当条件下都能发生水解反应 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水且密度比水小的液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com