
【题目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
A.上述过程中,最终被还原的是NO3-
B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述过程中,会产生一种无色的难溶于水的气体
D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2
【答案】B
【解析】
A.SO2通入硝酸铁稀溶液中,溶液由棕黄色变为浅绿色,是因为Fe3+与SO2发生氧化还原反应生成SO42-、Fe2+;溶液立即又变为棕黄色,是因为Fe2+与NO3-、H+发生氧化还原反应生成Fe3+,所以最终被还原的是NO3-,故A正确;
B.SO2能够被Fe3+氧化成H2SO4,Fe2+能够被稀硝酸氧化成Fe3+,则氧化性:稀硝酸>Fe3+>稀硫酸,故B错误;
C.稀溶液中,NO3-在酸性环境中被还原为NO,NO是无色的难溶于水的气体,故C正确;
D.上述过程中,最终被还原的是NO3-,故整个过程相当于SO2和NO3-之间发生了氧化还原反应,由关系式3SO2~2NO3-可知,SO2与NO的体积比为3∶2,故D正确;
故答案为B。
【题型】单选题
【结束】
14
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
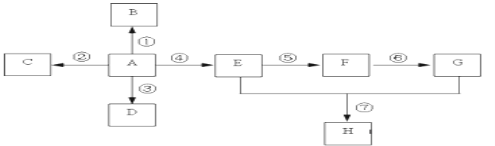
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式
反应①__________________;
反应⑤_____________________;
反应⑦ _______________________。
(3)写出下列反应类型:反应④___________,反应⑤___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构式如图,其中W、X、Y、Z为原子序数依次增大的短周期元素,Y原子核外最外层电子数是其电子层数的3倍,X与Z位于不同的周期,下列有关说法正确的是

A.气态氢化物的热稳定性:X>Y
B.X、W、Z三者形成的化合物都是液体
C.W2Y2中既含极性键又含非极性键
D.Z元素形成的含氧酸全部是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
【答案】D
【解析】
根据反应①2Fe3++Fe=3Fe2+可知,铁溶解,固体质量减少,根据反应②Cu2++Fe=Cu+Fe2+可知,铁溶解,铜析出,固体质量增加,而反应结束后,称得剩余固体质量与所加铁屑的质量相等,则反应①中固体减少的质量与反应②中固体增加的质量相等,即56 g·mol-1×![]() =(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
=(64g·mol-1-56g·mol-1)×n(Cu2+),得n(Fe3+)∶n(Cu2+)=2∶7,故n(FeCl3)∶n(CuCl2)=2∶7,故答案为D。
【点睛】
考查Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键;根据Fe3+、Cu2+的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无Fe3+存在,一定存在Fe2+,可能含有Cu2+;若有铁剩余,一定有铜生成,Fe3+和Cu2+无剩余。
【题型】单选题
【结束】
7
【题目】下列说法正确的是( )
A.绿矾是含有一定量结晶水的硫酸亚铁,在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:样品中没有Fe3+,Fe2+易被空气氧化为Fe3+
B.在给定条件下,Fe![]() FeCl2
FeCl2![]() Fe(OH)2可以实现
Fe(OH)2可以实现
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.铁比铜金属性强,故用FeCl3溶液腐蚀印刷电路板上的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
【答案】C
【解析】
根据题意需将SO32-氧化成SO42-,需加入氧化剂;
A.酸性高锰酸钾具有强氧化性,但是用H2SO4酸化,引入了SO42-,使测定结果偏大,故A错误;
B.0.5mol·L-1NaOH溶液中NaOH不是氧化剂,故B错误;
C.新制氯水可以将SO32-氧化成SO42-,故C正确;
D.KI溶液溶液中KI不是氧化剂,故D错误;
故答案为C。
【题型】单选题
【结束】
15
【题目】CO2气体中含有少量的SO2,欲用如图所示装置得到干燥纯净的CO2,则下列叙述正确的是( )
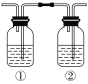
A.先让混合气体通过盛有NaOH溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②
B.先让混合气体通过盛有饱和NaHCO3溶液的洗气瓶①,再通过盛有浓H2SO4的洗气瓶②
C.先让混合气体通过盛有Na2CO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①
D.先让混合气体通过盛有饱和NaHCO3溶液的洗气瓶②,再通过盛有浓H2SO4的洗气瓶①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向氯化亚铁溶液中通入氯气,浅绿色溶液变成棕黄色溶液,说明Fe2+具有还原性,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A正确;
B.在氯化亚铁溶液中加入锌片,浅绿色溶液变成无色溶液,说明Fe2+具有氧化性,发生的离子反应为Fe2++Zn=Fe+Zn2+,故B错误;
C.离子方程式电荷不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故C错误;
D.在氯化铁溶液中加入铜粉,溶液颜色应由棕黄色变成蓝色,故D错误;
故答案为A。
【题型】单选题
【结束】
18
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )

A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是实验室常用的氧化剂。某实验小组制备高锰酸钾,具体流程如图:

实验一:锰酸钾的制备。称取3.0 g KClO3固体和 7. 0 g KOH固体混合,于铁坩埚中小火加热,待混合物熔融后用铁棒不断搅拌,再加入4.0g MnO2 继续加热。
(1)熔融时加人 MnO2 后坩埚中反应的化学方程式为 _____________。
(2)用铁棒而不用玻璃棒搅拌的原因是______________ 。
实验二:锰酸钾的歧化。待铁坩埚冷凉后放人烧杯中,加水共煮浸取,取出坩埚,开启启普发生器,趁热向溶液中通入CO2,直到溶液绿色全部变为紫色为止,静置沉淀,用砂芯漏斗进行抽滤,留滤液。歧化反应实验装置如图所示:

(3)向启普发生器中加入块状固体的位置_______ (选填字母“a”“b”或“ c”)。该仪器的优点是方便控制反应的发生与停止,其原理是_____________。
(4)烧杯中锰酸钾歧化反应的化学方程式为___________________。
(5)锰酸钾歧化时不能用盐酸代替 CO2,原因是_______________ 。
实验三:锰酸钾的浓缩结晶。将滤液转移至蒸发皿中,蒸发浓缩,自然冷却结晶,抽滤至干。将晶体转移至已知质量的表面皿上,放入烘箱中 80℃ 干燥半小时左右,冷却,称量,产品质量为 3.16 g。
(6)蒸发浓缩滤液至___________停止加热。
(7)该实验小组制备高锰酸钾的产率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
物质编号 | 物质转化关系 | A | D | E |
① |
| Si | SiO2 | Na2SiO3 |
② | S | SO3 | H2SO4 | |
③ | Na | Na2O2 | NaOH | |
④ | N2 | NO2 | HNO3 |
A.②③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com