
 ��1����֪��3H2��g��+3CO��g���TCH3OCH3��g��+CO2��g������H=-247kJ/mol��һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��AE��
��1����֪��3H2��g��+3CO��g���TCH3OCH3��g��+CO2��g������H=-247kJ/mol��һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��AE��| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.01 | 0.2 | 0.2 |
���� ��1��Ҫ���CO��ת���ʣ�Ӧʹƽ��������Ӧ�����ƶ���
��2��2CH3OH��g���TCH3OCH3��g��+H2O��g��
��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ����ƽ��Ũ�ȼ��㣻
�ڼ�������ѵķ�Ӧ���ʣ���Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���v��CH3OH��������Ũ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
��3���ٻ�ѧƽ��ͼ�����������ƽ��ͼ������Ҫע������һ���ƣ������ǣ�ͼ�����㡢�յ㡢�յ㣬һ�����ǿ����ߵı仯���ƣ���ȻҪ���úᡢ�������������
�ڶ���һ�������Ļ�ѧ��Ӧ����ѧƽ�ⳣ����Ӱ������ֻ���¶ȣ�
��ȼ�ϵ�ص������缫��Ӧʽ��д��ֻ������д����
���ԣ�O2+4e-+4H+=2H2O
���ԣ�O2+4e-+2H2O=4OH-
��� �⣺��1��A������Ӧ���ȣ����¶ȿ�ʹƽ�����������ƶ�������ѹǿƽ�����������ƶ���CO��ת��������A��ȷ��
B���������ƽ�ⲻ�ƶ�����B����
C������������N2��ƽ�ⲻ�ƶ�����C����
D������COŨ�ȣ�CO��ת���ʽ��ͣ���D����
E������������ѣ���ʹƽ�����������ƶ���CO��ת���������E��ȷ��
�ʴ�Ϊ��AE��
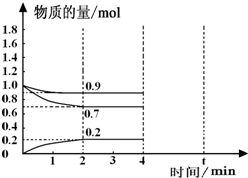
��2�����ɱ����е����ݼ�K�Ķ����֪��2CH3OH��g���TCH3OCH3��g��+H2O��g��
��Ӧ��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OC{H}_{3}��c��{H}_{2}O��}{{c}^{2}��C{H}_{3}OH��}$=$\frac{0.2��0.2}{0.0{1}^{2}}$=400��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OC{H}_{3}��c��{H}_{2}O��}{{c}^{2}��C{H}_{3}OH��}$��400��
���ɱ����е����ݿ�֪��v��CH3OCH3��=$\frac{0.2mol/L}{10min}$=0.02 mol•L-1•min-1���ַ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�
v��CH3OH��=2��0.02 mol•L-1•min-1=0.04 mol•L-1•min-1��
��ƽ��������������ټ���0.01mol CH3OH��0.2mol CH3OCH3��c��CH3OH��=0.02mol/L��c��CH3OCH3��=0.4mol/L c��H2��=0.2mol/L
Q=$\frac{0.2��0.4}{0.0{2}^{2}}$=200��K��˵��ƽ��������У�v����v����
�ʴ�Ϊ��0.04 mol•L-1•min-1������
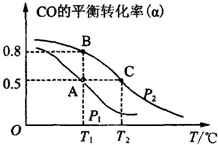
��3���ٴ�ͼ�Ͽɼ�����P2ʱ�����¶ȵ�����CO��ת����Խ��Խ�ͣ��ɼ�������ʱƽ���������ƶ�������������ԭ��������Ӧ���ȣ�
�ʴ�Ϊ������
�ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�÷�Ӧ���ȣ��¶�Խ��ƽ�������ƶ���Kֵ��С��
�ʴ�Ϊ��KA=KB��KC��
��ȼ�ϵ�ص���������������Ӧ���ڼ�����������ˮ����������������O2+2H2O+4e-=4OH-��
�ʴ�Ϊ��O2+2H2O+4e-=4OH-��
���� ���⿼����ۺϣ���Ҫ��ƽ�ⳣ������ѧƽ��ͼ��ƽ���ƶ�Ӱ�����ء�ԭ��ص缫��Ӧ��д�ȣ����ط�������������������֪ʶǨ��Ӧ�������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ҵ�Ϻϳɺϳɰ����Ȼ�ѧ����ʽ���£�N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol
��ҵ�Ϻϳɺϳɰ����Ȼ�ѧ����ʽ���£�N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| ѡ�� | �� | �� | �� | �Թ������� |
| A | Ũ��ˮ | ��ʯ�� | Al��SO4��3��Һ | �ȳ�������ʧ |
| B | Ũ���� | ͭ | ����KI��Һ | �Թܿڳ��ֺ���ɫ��Һ��Ϊ��ɫ |
| C | Ũ���� | �������� | ʯ����Һ | �ȱ�����ɫ |
| D | ˫��ˮ | �������� | ������ | ��Һ���ֻ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ե������ڷ�Ӧ��һ���������� | |
| B�� | ������ԭ��Ӧ��ʵ���ǵ���ת�� | |
| C�� | ijԪ�ش�����̬��Ϊ����̬����Ԫ��һ�������� | |
| D�� | ��Ӧ�е���һ��Ԫ�ر�����ʱ��һ������һ��Ԫ�ر���ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ���γɵ�Al��OH��3����������ˮ�������������ˮ�ľ��� | |
| B�� | ���������������������ͻ���� | |
| C�� | Fe2O3�׳����죬��������ɫ�������Ϳ�� | |
| D�� | Na2O2����ǿ�����ԣ�����������������еĹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
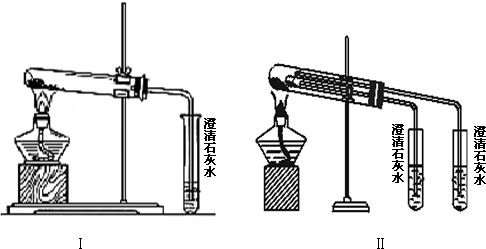
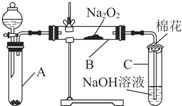 Ϊ��̽��SO2��Na2O2�ķ�Ӧ�Ƿ�������CO2��Na2O2�ķ�Ӧ����ͬѧ�������ͼ��ʾ��ʵ��װ�ã��ش��������⣺
Ϊ��̽��SO2��Na2O2�ķ�Ӧ�Ƿ�������CO2��Na2O2�ķ�Ӧ����ͬѧ�������ͼ��ʾ��ʵ��װ�ã��ش��������⣺| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡB�е�����������Ʒ���Թ��У��μ���������ˮ���ܽ⣬Ȼ��ȡ��������Һ�ֱ����ڢ��Թ��� | ������ȫ�ܽ� |
| ����2�������Թ��м���1mol•L-1���ᣬ�ٵμ�1mol•L-1BaCl2��Һ | �а�ɫ�������ɣ���֤���������к�Na2SO4�� |
| ��֤���������к�Na2SO4 | |
| ����3�������Թ��м���2��3��0.01mol•L-1KMnO4������Һ�� | |
| �� | ��KMnO4��Һ�Ϻ�ɫ��ȥ����֤������������Na2SO3���� |
| ��֤������������Na2SO3���� | |
| ��KMnO4��Һ�Ϻ�ɫ����ȥ�� | |
| ��˵����������û��Na2SO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com