


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeO |
| B、Fe3O4 |
| C、Fe2O3 |
| D、FeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 | ||||
B、0.1 mol?L-1氨水加水稀释后,溶液中
| ||||
| C、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | ||||
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、常压下,W的常见单质有金刚石和石墨 |
| B、Z的阳离子与Y的阴离子电子层结构相同 |
| C、X的气态氢化物比Y的气态氢化物稳定 |
| D、W元素的金属性比Z元素的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
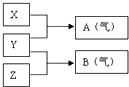 X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com