
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c (CO32ˉ)+c (HCO3ˉ)=0.1 mol•L-1 | |
| C. | 根据上表,水解方程式ClOˉ+H2O?HClO+OHˉ的水解常数K≈10ˉ7.6 | |
| D. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,
A.酸性H2CO3>HClO,同浓度酸溶液离子浓度越大导电性越强;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) ①,溶液中还存在物料守恒:3c(Na+)=5c(HCO3-)+5c(CO32- )+5c(H2CO3) ②,计算分析判断;
C.水解方程式ClOˉ+H2O?HClO+OHˉ的平衡常数为K=$\frac{c(HClO)c(O{H}^{-})}{c(Cl{O}^{-})}$;
D.向上述NaClO溶液中通HF气体至恰好完全反应时生成HClO,c(H+)<c(HClO).
解答 解:相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,
A.酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HCO3-<HClO<HF,但酸性H2CO3>HClO,故A错误;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) ①
溶液中还存在物料守恒:3c(Na+)=5c(HCO3-)+5c(CO32- )+5c(H2CO3) ②
将①×3-②可得:3c(OHˉ)-c(CO32- )=3c(H+)+2c(HCO3ˉ)+5c(H2CO3),故B错误;
C.ClO-+H2O?HClO+OH-的平衡常数为K=$\frac{c(HClO)c(O{H}^{-})}{c(Cl{O}^{-})}$=$\frac{1{0}^{-4.3}×1{0}^{-4.3}}{0.1}$=10-7.6,故C正确;
D.反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误.
故选C.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解,为高频考点,注意从电荷守恒的角度解答,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作现象 | 实验结论 |
| A | 向取了少量的KClO3晶体的试管中加入适量的蒸馏水,再向其中加入硝酸酸化的AgNO3溶液 | 该方法可以检验KClO3中是否含有氯元素 |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色,将褪色溶液加热,品红颜色复原 | 该气体一定是SO2 |
| D | 向AgNO3溶液中加入足量的NaCl溶液,再加入KI溶液,再加入Na2S溶液,先后有白色沉淀变为黄色沉淀,最后又白色变为黑色沉淀 | Ksp(AgCl)>Ksp(AgI)>Ksp(Ag2S) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
根据下列实验操作和现象所得到的结论正确的是
A.向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝
B.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性
D.向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | NaOH溶液 | C. | KSCN溶液 | D. | 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图夹紧弹簧夹,由漏斗中加水至产生液面差,一段时间后液面差不变,说明气密性良好 | |
| B. | 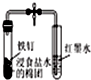 如图打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀 | |
| C. | 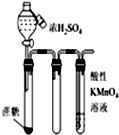 如图滴入浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化碳 | |
| D. | 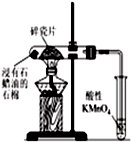 如图加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com