
 X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )| A. | R的氧化物都含有离子键 | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | Y形成的化合物种类最多 |
分析 X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.Na的氧化物由氧化钠和过氧化钠两种;
B.元素的非金属性越强,其最高价含氧酸的酸性越强;
C.M的氢化物的硫化氢;
D.C元素形成的有机物种类繁多.
解答 解:X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.Na的氧化物由氧化钠和过氧化钠两种,但不论是氧化钠还是过氧化钠,结构中均含离子键,故A正确;
B.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸酸性Z>Y,故B错误;
C.M的氢化物的硫化氢,常温下为气体,故C正确;
D.Y为碳元素,而C元素形成的有机物种类繁多,远多于无机物的种类,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,侧重考查学生推断及知识综合运用、灵活运用能力,明确离子半径比较方法、最高价含氧酸比较方法、物质结构是解本题关键,注意规律中的反常现象,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4+NaOH=Na2SO4+H2O | B. | CH3COOH+NaOH→CH3COONa+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | NH3•H2O+HCl→NH4Cl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
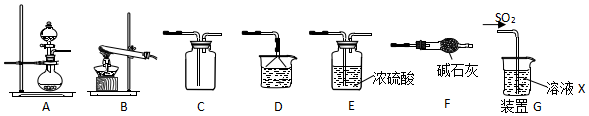
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com