
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。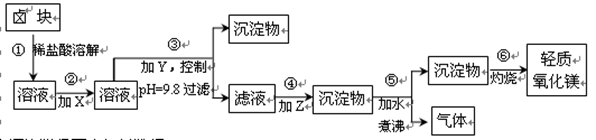
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
(16分)
(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚 (2分)
(5)Mg(OH)2(s) 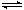 Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
解析试题分析:(1)流程图中加入X的目的是将亚铁离子氧化为铁离子,考虑氧化剂的价格,应该选择漂粉;加入Y的目的是调节溶液的pH,使铁离子、锰离子沉淀,碳酸钠溶液显碱性,但碱性不强,所以选择用氢氧化钠;加入Z的目的是使镁离子沉淀,所以选择碳酸钠,且加水煮沸,使生成的碳酸镁沉淀转化为氢氧化镁沉淀,成本较低,因此试剂X、Y、Z最佳选择依次是表2中的a、c、d;
(2)加入NaClO的目的是将亚铁离子氧化为铁离子,离子方程式为2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;步骤⑤是把碳酸镁沉淀转化为氢氧化镁,化学方程式为MgCO3 + H2O△Mg(OH)2+ CO2↑;
(3)根据表1中的数据可知,pH=9.8时铁离子、锰离子完全沉淀,而镁离子开始沉淀,而流程的要求是产品尽量不含杂质,所以步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去;
(4)灼烧时用到的仪器有铁三脚、酒精喷灯、坩埚和泥三角。
(5)NH4Cl溶液中的铵根离子与溶解平衡中Mg(OH)2(s) 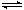 Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
考点:考查物质制备,对流程图的分析判断,利用信息的能力,实验仪器的选择,溶解平衡的移动


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
配合物在许多方面有着广泛的应用。下列叙述不正确的是
| A.CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+ |
| B.魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液 |
| C.[Ag(NH3)2]+是化学镀银的有效成分 |
| D.除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)湿法炼锌的冶炼过程可用下图简略表示: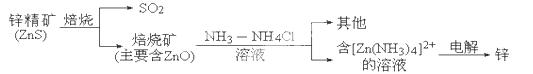
请回答下列问题:
(1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a 0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
(3)电解过程中析出锌的电极反应式为___________________________.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为 。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)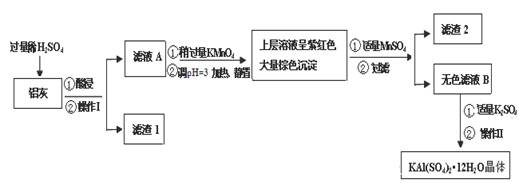
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: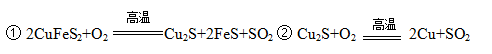
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。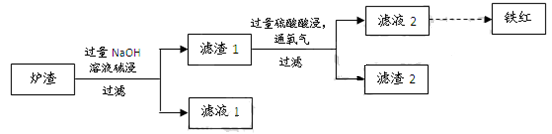
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、 、
、 两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液白色沉淀沉淀不溶解
C溶液白色沉淀沉淀不溶解
D溶液白色沉淀沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:
A ;B ;C ;D ;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式 。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是 。用离子方程式表示其原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下: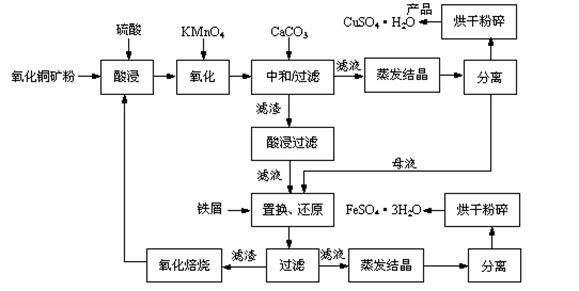
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。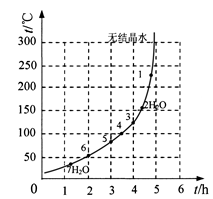
硫酸亚铁干燥曲线图
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(创新预测题)(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为________,离子方程式为__________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为______________________________。离子方程式是_______________________________。
③对比①和②实验所得的结果,将I2、ClO-、SO42—性由强到弱的顺序排列为_____________________________。
(2)今有铁片、铜片,设计实验证明以下事实,并写出反应的化学方程式。
①浓硫酸的氧化性比稀硫酸强。________________________________。
②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强。__________________________。
③铁的还原性比铜强。
___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com