
【题目】滴定实验是化学学科中最重要的定量实验之一。常见的滴定实验有酸碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
(1)酸碱中和滴定——用0.1000mol/LHCl标准溶液测定某NaOH溶液的物质的量浓度(用酚酞作指示剂),做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol/LHCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 25.01 |
2 | 25.00 | 1.56 | 26.56 |
3 | 25.00 | 0.21 | 25.20 |
计算出待测NaOH溶液的物质的量浓度为_____________________________(小数点后保留四位)。
(2)氧化还原滴定——葡萄酒中抗氧化剂残留量的测定,葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

注:实验中加入盐酸的目的是将Na2S2O5全部转化成SO2;滴定过程中发生的反应是:I2 + SO2 + 2H2O ![]() 2HI + H2SO4
2HI + H2SO4
①滴定时,I2溶液应装在__________(“酸”或“碱”)式滴定管中,判断滴定终点的方法是:当滴入最后一滴碘溶液时,溶液由_________________________,且保持30s不变。
②实验消耗标准I2溶液25.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为___________g/L。
③下列情形会造成测定结果偏高的是_____________。
A.滴定持续时间稍长,溶液中部分HI被空气氧化 B.滴定前平视,滴定后俯视
C.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是_____________(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
【答案】 0.1000mol/L 酸 无色变为蓝色 0.16 C D D
【解析】(1)三次实验消耗标准液体积分别是25.01mL、25.00mL、24.99mL,所以消耗标准液体积的平均值是25.00mL,则待测NaOH溶液的物质的量浓度为![]() =0.1000mol/L。
=0.1000mol/L。
(2)①I2溶液有氧化性,会腐蚀橡胶管,I2溶液应装在酸式滴定管中,用淀粉做指示剂,在滴定终点时,当滴入最后一滴碘溶液时,溶液由无色变为蓝色,且保持30s不变;
②令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2 + 2H2O +I2=2HI + H2SO4
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.016g÷0.1L=0.16 g/L;③A.若有部分HI被空气氧化,则消耗碘的量偏小,使测定结果偏低;B.滴定前平视,滴定后俯视,读取的碘溶液的体积偏小,使测定结果偏低;C.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗,所用的碘溶液的浓度偏低,用掉的碘溶液的体积偏大,使测定结果偏高;D.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则消耗碘溶液的体积偏大,使测定结果偏高,答案选CD;
(3)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,答案选D。


科目:高中化学 来源: 题型:
【题目】下列各物质中所含氢原子个数与3.2g O2 所含的分子数相同的是( )
A. 0.2gNH3 B. 0.1mol HCl分子
C. 6.02×1023个H2SO4分子 D. 标准状况下1.12L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
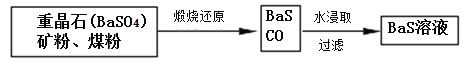
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
D. HS-的电离:HS-+H2O![]() OH-+HS-
OH-+HS-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2X为二元弱酸,常温下,0.1 mol/L的NaHX溶液中c(H+) > c(OH-),下列关系中一定正确的是
A. c(Na+) + c(H+) = c(HX-) + 2c(X2-) B. c(H+)·c(OH-) = 10-14 mol2·L-2
C. c(Na+) = c(X2-) + c(HX-) D. 溶液中pH = 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
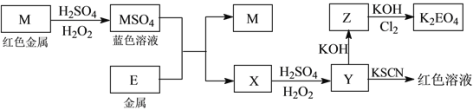
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
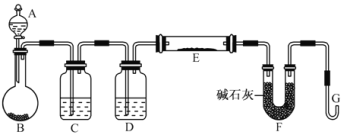
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,物质的量最大的是__________,含分子个数最多的是________,含原子个数最多的是_________,质量最大的是__________(填字母)。
A.6g氢气 B.0.5molCO2 C.1.204×1023个CO分子 D.147g H2SO4 E.92g乙醇(C2H5OH)
(2)NA表示阿伏加德罗常数的值
①1.204×1023个水分子中共________mol氢原子。
②某气体在同温同压下对H2相对密度为32,则该气体的相对分子质量为__________。
③某气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是___g/mol。
④25g CuSO4·5H2O晶体中含有氧原子______个。
⑤16gO2含有的氧分子数与______g CO2含有的氧原子数相等。
⑥标准状况下,11.2 L CH4中含有的氢原子数为________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com