
【题目】少量下列物质放入滴有酚酞的水后,溶液最终显红色的是( )
A.NaB.KClC.NH4ClD.Fe2O3
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水是弱电解质,电离方程式为H2O+H2O![]() H3O++OH-
H3O++OH-
B.常温下,向水中加入H2SO4溶液,H+ 浓度增大,Kw增大
C.将纯水加热到100℃,pH≈6,显酸性
D.常温下,将0.1mol·L-1的 NaOH溶液体积稀释到原来的10倍,则pH=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 五种主族元素分属三个短周期,且原子序数依次增大。A、C 同主族,可形成离子化合物 CA;B、D 同主族,可形成 DB2、DB3 两种分子。请回答下列问题:
(1)五种元素原子半径由小到大的顺序为_______________(用元素符号回答)。
(2)A、B 两种元素能形成既含极性键又含非极性键的化合物 M,M 的电子式为_______________。
(3)非金属性强弱:D_______________E(填“>”“<”),用离子方程式表示__________________________。
(4)写出均由 A、B、C、D 四种元素组成的两物质的浓溶液发生反应的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a曲线表示一定条件下X(g)+Y(g)![]() 2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )
2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )

A.加入催化剂B.增大Y的浓度C.降低温度D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。

(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否褪色?____(填“是”或“否”);写出F中反应的化学反应方程式:________________,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),若将紫色石蕊溶液滴入新制氯水中,可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国对环境问题的重视,碳、氮及其化合物的研究备受关注。
已知:Ⅰ![]()
![]() ;
;
Ⅱ![]()
![]() ;
;
Ⅲ![]()
![]()
![]() .
.
请回答下列问题:
(1)![]() ________。
________。
(2)一定温度下,向刚性容器中充入![]() 和足量
和足量![]() ,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。

![]() 已知曲线a代表
已知曲线a代表![]() 的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
![]() 该刚性容器的容积为________;
该刚性容器的容积为________;![]() 内,
内,![]() 的消耗速率
的消耗速率![]() ________。
________。
![]() 该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________
该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________![]() 填“反应Ⅰ”或“反应Ⅱ”
填“反应Ⅰ”或“反应Ⅱ”![]() ,原因为________。
,原因为________。
![]() 该温度下,反应Ⅲ的化学平衡常数
该温度下,反应Ⅲ的化学平衡常数![]() Ⅲ
Ⅲ![]() ________。
________。
(3)若其他条件不变,将恒温容器改为绝热容器,再次达到平衡后,与原平衡相比,CO的体积分数________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() ,原因为________。
,原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是
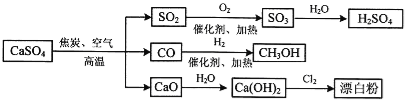
A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱工业是基本无机化工之一。完成下列填空:
(1)常温下向纯碱溶液中滴加酚酞试液,溶液变红,原因是___(用离子方程式表示);继续滴加足量氯化钡溶液,可以看到__。
(2)最早的勒布朗法制碱涉及如下反应:Na2SO4+2C+CaCO3![]() Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
Na2CO3+CaS+2CO2↑。该反应中被还原的元素是___。若转移6.02×1024个电子,生成CO2在标准状况下的体积为__L。
(3)索尔维法(氨碱法)是工业生产纯碱的主要方法,其主要原理可以表示为:NaCl(饱和)+H2O+CO2+NH3=NaHCO3↓+NH4Cl。该反应涉及的各物质中,属于弱电解质的是___。综合平衡理论解释通入CO2和NH3后为何会有NaHCO3析出___。
(4)侯德榜对索尔维法进行了改进,利用平衡移动原理从析出NaHCO3后的母液中提取NH4Cl产品,所需的物质有___(填化学式)。
(5)纯碱厂在生产过程中要时刻关注设备的腐蚀情况。输送饱和食盐水的铸铁管道受到腐蚀时,正极的电极反应方程式为:___。为缓解腐蚀,可在铸铁管道上固定铝-锌-镉三元合金,该方法称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:

已知:①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1) A的结构简式是____________________。
(2)B中的官能团名称是______________________。
(3)D→E的反应类型是______________。
(4)①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是______________。
(5) E的名称是___________。
(6) G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
② 1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7) 写出由![]() 合成
合成![]() 的流程图(注明反应条件)________。
的流程图(注明反应条件)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com