
| A. | 将322 g Na2SO4•10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol/L | |
| B. | 将含2 mol H2SO4的溶液加水稀释到2 L,所得溶液中H2SO4的物质的量浓度为1 mol/L | |
| C. | 将1 L 18.4 mol/L的H2SO4溶液加入1 L水中,所得溶液的物质的量浓度为9.2 mol/L | |
| D. | 将336 mL HCl气体溶于300 mL水,所得溶液的物质的量浓度为0.05 mol/L |
分析 A.1L为溶剂的体积,溶液体积未知;
B.稀释前后溶质的物质的量不变;
C.等体积时,水的质量小于硫酸的质量;
D.状况未知,Vm不确定.
解答 解:A.将322 g Na2SO4•10H2O溶于1 L水中,溶液的体积不是1 L,无法计算出溶液的物质的量浓度,故A错误;
B.将含2 mol H2SO4的溶液加水稀释到2 L,溶质的物质的量不变,所得溶液中H2SO4的物质的量浓度为$\frac{2mol}{2L}$=1 mol/L,故B正确;
C.18.4 mol/L的H2SO4溶液密度大于1,和水等体积混合,溶质浓度大于平均值,将1 L 18.4 mol/L的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度大于9.2 mol/L,故C错误;
D.气体体积不一定在标准状况下,336 mL HCl气体的体积不一定是0.015 mol,溶液的体积也不一定是300 mL,无法计算,故D错误;
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量、浓度、体积的关系为解答的关键,侧重分析与计算能力的考查,注意溶剂与溶液体积的判断及Vm的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氯化铝溶液 | C. | 稀氨水 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中 | Ksp(AgCl)>Ksp(Ag2S) |
| B | 室温下,向浓度均为0.1 mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 室温下,用pH试纸测得0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
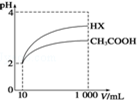 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
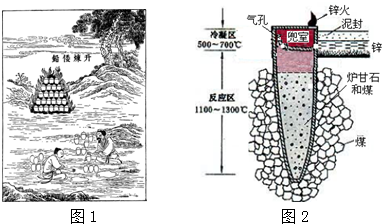
| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com