
| A. | 使用催化剂可以提高该反应的焓变 | |
| B. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| C. | 反应450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量 |
分析 A.催化剂不改变反应的始终态;
B.增大O2的浓度,反应速率加快,且平衡正向移动;
C.该反应为放热反应,升高温度平衡逆向移动;
D.反应物的总能量大于生成物的总能量,为放热反应.
解答 解:A.催化剂不改变反应的始终态,则使用催化剂,该反应的焓变不变,故A错误;
B.增大O2的浓度,反应速率加快,且平衡正向移动,则SO2的转化率增大,故B正确;
C.该反应为放热反应,升高温度平衡逆向移动,则反应450℃时的平衡常数大于500℃时的平衡常数,故C错误;
D.反应物的总能量大于生成物的总能量,为放热反应,则2 mol SO2(g) 和1 mol O2(g)所含的总能量大于2 mol SO3(g) 所含的总能量,故D错误;
故选B.
点评 本题考查化学平衡,为高频考点,把握化学反应速率及平衡的影响因素、K与温度的关系、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
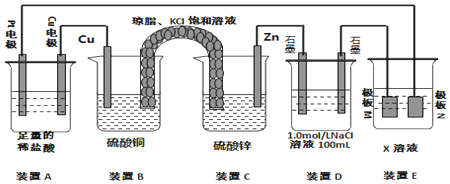
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
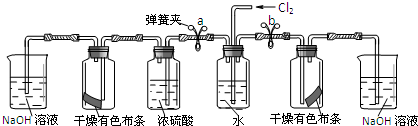
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
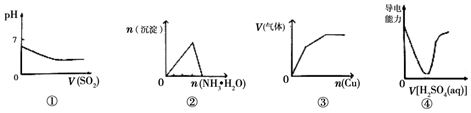
| A. | 图①表示将二氧化硫通入到一定量氯水中 | |
| B. | 图②表示将氨水滴入到一定量氯化铝溶液中 | |
| C. | 图③表示将过量铜粉加入到一定量浓硝酸中 | |
| D. | 图④表示将稀硫酸滴加到Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为11.2 L | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 40 g NaOH溶解在1 L水中,所制得的100 mL溶液中含Na+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com