
| A. | 分散质粒子的直径小于1nm | B. | 都是红褐色 | ||
| C. | 都有丁达尔效应 | D. | 都比较稳定 |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| B. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
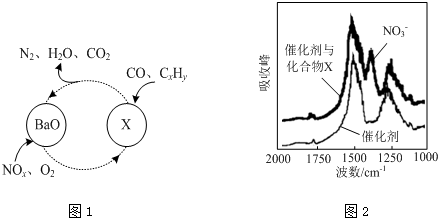
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 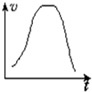 此图表示一定条件下某化学反应速率随时间变化趋势图,该反应不可能为吸热反应 | |
| B. | 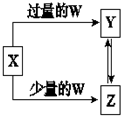 此图中X可以是H2S,W可以是O2 | |
| C. | 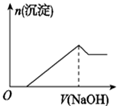 此图表示向AlCl3、MgCl2的混合液中逐滴滴入NaOH至过量 | |
| D. | 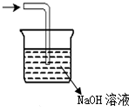 此图可以用来直接处理像H2S、Cl2、NO等尾气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com